Calciumsulfaat (CaSO4) is een wit poeder dat van nature voorkomt of industrieel wordt geproduceerd. Het wordt gebruikt in de bouw, voeding en geneeskunde vanwege zijn eigenschappen als bindmiddel, vulmiddel en voedingsstof.
| IUPAC-naam | Calciumsulfaat |
| Moleculaire formule | CaSO4 |
| CAS-nummer | 7778-18-9 |
| Synoniemen | Gips, watervrij gips, anhydriet, dihydraat, calciumzout, seleniet |
| InChi | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschappen van calciumsulfaat
Calciumsulfaatformule
De chemische formule voor calciumsulfaat is CaSO4. Dit betekent dat elk calciumsulfaatmolecuul één calciumatoom, één zwavelatoom en vier zuurstofatomen bevat. De formule wordt gebruikt om de samenstelling van calciumsulfaat in chemische vergelijkingen weer te geven en om de hoeveelheid reactanten te berekenen die nodig zijn bij chemische reacties.
Calciumsulfaat Molaire massa
De molaire massa van CaSO4 is ongeveer 136,14 g/mol. Deze waarde wordt berekend door de atoommassa’s van één calciumatoom, één zwavelatoom en vier zuurstofatomen in de verbinding op te tellen. De molaire massa wordt gebruikt om de hoeveelheid CaSO4 te bepalen die nodig is bij chemische reacties en om de concentratie ervan in oplossingen te berekenen.
Kookpunt van calciumsulfaat
CaSO4 heeft geen gedefinieerd kookpunt omdat het thermische ontleding ondergaat voordat het zijn kookpunt bereikt. Het kan echter worden verwarmd tot temperaturen boven 200°C zonder ontleding te ondergaan. Bij hogere temperaturen ondergaat CaSO4 endotherme ontleding om calciumoxide en zwaveltrioxide te vormen.
Smeltpunt van calciumsulfaat
Het smeltpunt van CaSO4 hangt af van de hydratatietoestand. De watervrije vorm van CaS04 heeft een smeltpunt van ongeveer 1460°C, terwijl de dihydraatvorm een lager smeltpunt heeft van ongeveer 128°C. De hemihydraat- en trihydraatvormen hebben tussenliggende smeltpunten.
Dichtheid van calciumsulfaat g/ml
De dichtheid van CaSO4 hangt af van de vorm en de hydratatietoestand. De watervrije vorm van CaSO4 heeft een dichtheid van ongeveer 2,96 g/ml, terwijl de dihydraatvorm een dichtheid heeft van ongeveer 2,32 g/ml. De hemihydrateerde en trihydrateerde vormen hebben tussenliggende dichtheden.
Calciumsulfaat Molecuulgewicht
Het molecuulgewicht van CaSO4 is ongeveer 136,14 g/mol. Deze waarde wordt berekend door de atoommassa’s van één calciumatoom, één zwavelatoom en vier zuurstofatomen in de verbinding op te tellen. Het molecuulgewicht wordt gebruikt om de hoeveelheid CaSO4 te berekenen die nodig is bij chemische reacties en om de concentratie ervan in oplossingen te bepalen.
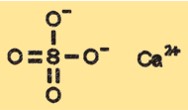
Structuur van calciumsulfaat
CaSO4 heeft een kristalstructuur die kan variëren afhankelijk van de hydratatietoestand. De watervrije vorm van CaSO4 heeft een kristalstructuur die is geclassificeerd als orthorhombisch, terwijl de dihydraatvorm een monokliene kristalstructuur heeft. De hemihydraat- en trihydraatvormen hebben verschillende kristalstructuren die tussen de watervrije en dihydraatvormen in liggen.
| Verschijning | Wit of vast poeder |
| Soortelijk gewicht | 2,96 (watervrij), 2,32 (dihydraat) |
| Kleur | Wit of kleurloos |
| Geur | Geurloos |
| Molaire massa | 136,14 g/mol |
| Dikte | 2,96 g/cm³ (watervrij), 2,32 g/cm³ (dihydraat) |
| Fusie punt | 1460°C (watervrij), 128°C (dihydraat) |
| Kookpunt | Heeft geen gedefinieerd kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 0,24 g/100 ml (20°C) |
| Oplosbaarheid | Oplosbaar in water en glycerol, onoplosbaar in ethanol |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 9,8 (eerste dissociatie), 11,8 (tweede dissociatie) |
| pH | 7 (neutraal) |
Veiligheid en gevaren van calciumsulfaat
CaSO4 wordt over het algemeen als veilig beschouwd om te gebruiken en te hanteren, maar het kan enkele gezondheidsrisico’s met zich meebrengen als het niet op de juiste manier wordt behandeld. Inademing van CaSO4-stof kan irritatie van de luchtwegen veroorzaken, terwijl inname van grote hoeveelheden van de stof maag- en darmklachten kan veroorzaken. Oog- en huidcontact met CaSO4 kan irritatie of uitdroging veroorzaken. CaSO4 kan ook reageren met bepaalde chemicaliën en gevaarlijke bijproducten produceren. Daarom moeten geschikte persoonlijke beschermingsmiddelen worden gedragen bij het hanteren van CaSO4 en moeten deze worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Schadelijk bij inslikking. Veroorzaakt huid- en oogirritatie. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2833.29.00 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijke stof of mengsel volgens Verordening (EG) nr. 1272/2008 [CLP] |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat): > 2000 mg/kg |
Methoden voor de synthese van calciumsulfaat
Verschillende methoden maken het mogelijk om CaSO4 te synthetiseren, afhankelijk van de gewenste vorm en de hydratatietoestand van de verbinding.
Een gebruikelijke methode is om calciumcarbonaat of calciumoxide te laten reageren met zwavelzuur. Bij de reactie ontstaan respectievelijk CaSO4 en koolstofdioxide of water.
Een andere methode omvat de reactie van calciumchloride met natriumsulfaat , resulterend in de precipitatie van CaSO4. Thermische dehydratatie van gips, een natuurlijke minerale vorm van CaSO4-dihydraat, produceert CaSO4.
Sommige industriële processen, zoals de ontzwaveling van rookgassen in elektriciteitscentrales, produceren CaSO4 als bijproduct. Tijdens dit proces reageert zwaveldioxide met calciumcarbonaat om calciumsulfiet te vormen, dat oxidatie ondergaat om CaSO4 te produceren.
De synthesemethode die voor CaSO4 wordt gebruikt, kan de eigenschappen ervan beïnvloeden, zoals deeltjesgrootte, kristalliniteit en zuiverheid. Het is daarom belangrijk om de methode te kiezen die geschikt is voor de beoogde toepassing van de verbinding.
Gebruik van calciumsulfaat
CaSO4 heeft veel toepassingen in verschillende industrieën vanwege zijn unieke eigenschappen, waaronder lage toxiciteit, hoog smeltpunt en witte kleur. Enkele veel voorkomende toepassingen van CaSO4 zijn:
- Constructie: Een belangrijk onderdeel van cement en gipsplaat, waar het fungeert als bindmiddel en stopverf.
- Voedsel en dranken: Gebruikt als stollingsmiddel bij de productie van tofu en als verstevigingsmiddel in sommige kazen en ingeblikte groenten.
- Farmaceutische producten: gebruikt als vulmiddel en bindmiddel bij de productie van tabletten en capsules.
- Landbouw: Gebruikt als bodemverbetering om de bodemstructuur te verbeteren en de gewasopbrengst te verhogen.
- Chemicaliën: Gebruikt bij de productie van verschillende chemicaliën, zoals pigmenten, papier- en textielverwerking.
- Cosmetica: Gebruikt in cosmetische formuleringen als vul- en ondoorschijnend middel.
- Waterbehandeling: Gebruikt bij waterbehandeling om onzuiverheden te verwijderen en kalkaanslag te verminderen.
- Kunststoffen en rubber: gebruikt als vul- en versterkingsmiddel in kunststof- en rubberproducten.
Vragen:
Vraag: Is calciumsulfaat veganistisch?
A: Ja, CaSO4 wordt als veganistisch beschouwd omdat het niet uit dierlijke bronnen komt.
Vraag: Wat was het belangrijkste gebruik van calciumsulfaat in ziekenhuizen?
A: CaSO4 werd in ziekenhuizen vaak gebruikt als gipsverband voor botbreuken.
Vraag: Welke massa calciumsulfaat en fosfor?
A: Deze vraag is onvolledig en vereist meer informatie om een specifiek antwoord te geven.
Vraag: Is CaSO4 oplosbaar in water?
A: CaSO4 is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 2,05 g/l bij kamertemperatuur.
Vraag: Is CaSO4 oplosbaar?
A: Calciumsulfaat heeft een lage oplosbaarheid in water, met een oplosbaarheid van ongeveer 2,05 g/l bij kamertemperatuur.
Vraag: Wat is de molaire massa van CaSO4?
A: De molaire massa van CaSO4 is ongeveer 136,14 g/mol.
Vraag: Welk zout heeft een pH < 7? KBr, HCOOK, CaSO4, NH4NO3
A: Geen van de genoemde zouten heeft in zuivere vorm een pH < 7. Wanneer NH4NO3 (ammoniumnitraat) echter wordt opgelost in water, ontstaat er een zure oplossing met een pH < 7.
