Magnesiumhydroxide (Mg(OH)2) is een maagzuurremmer en laxeermiddel dat wordt gebruikt om brandend maagzuur, indigestie en constipatie te behandelen. Het werkt door maagzuur te neutraliseren en water in de dikke darm te zuigen om de stoelgang te bevorderen.
| IUPAC-naam | Magnesium hydroxide |
| Moleculaire formule | Mg(OH)2 |
| CAS-nummer | 1309-42-8 |
| Synoniemen | Magnesiummelk; Bruciet; Magnesiumdihydroxide; Hydromagnesiet; Witte magnesiumoxide |
| InChi | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Eigenschappen van magnesiumhydroxide
Magnesiumhydroxide-formule
De chemische formule voor magnesiumhydroxide is Mg(OH)2. Deze formule geeft aan dat een magnesiumatoom gebonden is aan twee hydroxide-ionen. De magnesiumhydroxideformule wordt gebruikt om de molaire massa, dichtheid en andere fysische eigenschappen van de stof te berekenen. De formule geeft ook inzicht in de structuur van de stof, omdat deze het aantal en de soorten atomen aangeeft die in een magnesiumhydroxidemolecuul aanwezig zijn.
Molaire massa van magnesiumhydroxide
De molmassa van Mg(OH)2 bedraagt 58,32 g/mol. Dit is de massa van één mol Mg(OH)2, die één mol Mg-atomen en twee mol OH-ionen bevat. Molaire massa is een belangrijk concept in de scheikunde omdat het wordt gebruikt om de hoeveelheid stof in een bepaald monster te berekenen.
Kookpunt van magnesiumhydroxide
Mg(OH)2 heeft geen duidelijk kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. De ontledingstemperatuur van Mg(OH)2 bedraagt ongeveer 350°C. Bij verhitting ontleedt Mg(OH)2 onder vorming van magnesiumoxide en water.
Smeltpunt van magnesiumhydroxide
Het smeltpunt van Mg(OH)2 bedraagt 350°C. Bij deze temperatuur verandert het vaste Mg(OH)2 naar de vloeibare toestand. Dit proces staat bekend als samenvoegen. Het smeltpunt is een belangrijke fysische eigenschap van een stof, omdat het de temperatuur bepaalt waarbij een vaste stof in een vloeistof verandert.
Dichtheid van magnesiumhydroxide g/ml
De dichtheid van Mg(OH)2 bedraagt ongeveer 2,36 g/ml. Dichtheid wordt gedefinieerd als de massa van een stof per volume-eenheid. Mg(OH)2 is een relatief dichte stof vanwege de hoge molaire massa en de aanwezigheid van twee OH-ionen per Mg-atoom.
Magnesiumhydroxide Molecuulgewicht
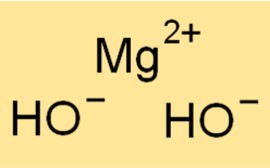
Het molecuulgewicht van Mg(OH)2 bedraagt 58,32 g/mol. Het is de som van de atoomgewichten van alle atomen in een molecuul Mg(OH)2. Molecuulgewicht is een nuttig concept in de scheikunde omdat het wordt gebruikt om de hoeveelheid van een stof in een bepaald monster te bepalen.
Structuur van magnesiumhydroxide
Mg(OH)2 heeft een gelaagde structuur bestaande uit Mg2+-ionen en OH–ionen. De Mg2+-ionen zijn omgeven door zes OH-ionen, en de OH-ionen zijn gerangschikt in een dicht opeengepakte hexagonale structuur. De gelaagde structuur van Mg(OH)2 geeft aanleiding tot zijn karakteristieke eigenschappen, zoals zijn lage oplosbaarheid in water en zijn vermogen om een suspensie in water te vormen.
| Verschijning | Wit poeder of suspensie |
| Soortelijk gewicht | 2,36 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 58,32 g/mol |
| Dikte | 2,36 g/ml |
| Fusie punt | 350°C |
| Kookpunt | Ontleedt bij 350°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 12 mg/L bij 20°C |
| Oplosbaarheid | Onoplosbaar in ethanol en ether |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 10.4 |
| pH | 10.5 |
Veiligheid en gevaren van magnesiumhydroxide
Mg(OH)2 wordt over het algemeen als veilig in gebruik beschouwd, met een lage toxiciteit en zonder bekende carcinogene effecten. Langdurige blootstelling aan Mg(OH)2-stof of -poeder kan echter irritatie van de luchtwegen en longschade veroorzaken. Mg(OH)2 kan bij contact ook irritatie of corrosie van ogen, huid en slijmvliezen veroorzaken. Het is belangrijk om de juiste veiligheidsmaatregelen te volgen bij het hanteren van Mg(OH)2, zoals het dragen van beschermende uitrusting en het werken in een goed geventileerde ruimte. In geval van contact of blootstelling dient u medische hulp in te roepen en de getroffen gebieden grondig af te spoelen met water.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | – Vermijd inademing en contact met ogen, huid en kleding. – Draag beschermende kleding, handschoenen en oog-/gezichtsbescherming. – Gebruik in een goed geventileerde ruimte. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2826.90.90 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit; langdurige blootstelling kan irritatie van de luchtwegen en longschade veroorzaken. |
Synthesemethoden voor magnesiumhydroxide
Verschillende methoden kunnen Mg(OH)2 synthetiseren, zoals precipitatie, hydrothermische synthese en elektrochemische afzetting.
De precipitatiemethode omvat het laten reageren van natriumhydroxide of ammoniumhydroxide met magnesiumchloride of magnesiumsulfaat om Mg(OH)2 te vormen. Bij de reactie ontstaat Mg(OH)2, dat iemand vervolgens kan verzamelen en drogen.
Om hydrothermische synthese uit te voeren, moet men water tot hoge druk en temperatuur verwarmen terwijl magnesiumoxide of magnesiumcarbonaat wordt toegevoegd. Het proces produceert Mg(OH)2 en je kunt de kristallen verzamelen door de resulterende oplossing af te koelen.
Bij elektrochemische afzetting wordt een elektrische stroom door een oplossing van magnesiumionen geleid, waardoor deze reageren met hydroxide-ionen en Mg(OH)2 vormen op de kathode.
Andere methoden voor het synthetiseren van Mg(OH)2 zijn onder meer het gebruik van magnesiumoxide en kalkmelk en de thermische ontleding van magnesiumbicarbonaat.
Elke methode heeft zijn voor- en nadelen in termen van effectiviteit, efficiëntie en kosten. De keuze van de synthesemethode hangt af van de specifieke toepassing en de gewenste eigenschappen van het Mg(OH)2-product.
Gebruik van magnesiumhydroxide
Mg(OH)2 heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Antacidum: Vaak gebruikt als antacidum om maagzuur te neutraliseren en brandend maagzuur, indigestie en andere spijsverteringsongemakken te verlichten.
- Vlamvertrager: een niet-giftige vlamvertrager die wordt gebruikt in kunststoffen, rubber en textiel om het risico op brand te verminderen.
- pH-aanpassing: Wordt gebruikt om de pH van verschillende producten aan te passen, waaronder waterbehandelingsoplossingen, cosmetica en farmaceutische producten.
- Milieusanering: Gebruikt bij de behandeling van afvalwater en zure mijndrainage om zure omstandigheden te neutraliseren en zware metalen te verwijderen.
- Meststof: Gebruikt als meststof om magnesium aan planten te geven en de pH van de bodem te verbeteren.
- Medische toepassingen: Gebruikt als laxeermiddel en bij sommige medische procedures, zoals colonoscopieën, om de darmen te reinigen.
- Andere toepassingen: Gebruikt als stabilisator in latexverf, als bleekmiddel in papier en als polijstmiddel in glas en keramiek.
Vragen:
Vraag: Wat is een basis die in tandpasta wordt gebruikt?
A: Mg(OH)2 wordt vaak gebruikt als basis in tandpasta’s om zure omstandigheden in de mond te helpen neutraliseren en het risico op tandbederf te verminderen.
Vraag: Wat is de formule voor magnesiumhydroxide?
A: De chemische formule voor magnesiumhydroxide is Mg(OH)2.
Vraag: Welke chemische vergelijking toont de dissociatie van magnesiumhydroxide?
A: De chemische vergelijking voor de dissociatie van Mg(OH)2 is:
Mg(OH)2 → Mg2+ + 2OH-.
Vraag: Is magnesiumhydroxide oplosbaar in water?
A: Mg(OH)2 is slecht oplosbaar in water, wat betekent dat het in zeer beperkte mate oplost.
Vraag: Welke van de volgende stoffen is een Arrhenius-zuur? BF3, HCN, NH3, Mg(OH)2?
A: Geen van de genoemde stoffen zijn Arrhenius-zuren. BF3 en HCN zijn Lewis-zuren, NH3 is een zwakke Arrhenius-base en Mg(OH)2 is een sterke Arrhenius-base.
Vraag: Is Mg(OH)2 oplosbaar in water?
A: Mg(OH)2 is slecht oplosbaar in water, wat betekent dat het in zeer beperkte mate oplost.
Vraag: Wat is de molaire massa van Mg(OH)2?
A: De molaire massa van Mg(OH)2 is ongeveer 58,32 g/mol.
Vraag: Is Mg(OH)2 een zuur of een base?
A: Mg(OH)2 is een base omdat het waterstofionen (protonen) kan accepteren om water en een zout te vormen.
