Kaliumfosfaat (K3PO4) is een verbinding die de elementen kalium en fosfor bevat. Het wordt vaak gebruikt als voedingsadditief en kunstmest vanwege de hoge oplosbaarheid en het vermogen om essentiële voedingsstoffen voor de plantengroei te leveren.
| Naam van IUPAC | Kaliumfosfaat |
| Moleculaire formule | K3PO4 |
| CAS-nummer | 7778-53-2 |
| Synoniemen | Trikaliumfosfaat, kaliumorthofosfaat, tertiair kaliumfosfaat, trikaliummonofosfaat, tribasisch kaliumfosfaat |
| InChi | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Eigenschappen van kaliumfosfaat
Kaliumfosfaatformule
De chemische formule voor kaliumfosfaat is K3PO4. Dit geeft aan dat de verbinding drie K+-ionen en één PO43-ion in elke formule-eenheid bevat. De kaliumfosfaatformule is nuttig voor het bepalen van de stoichiometrie van reacties waarbij de verbinding betrokken is, evenals voor het identificeren van de hoeveelheid van elk element dat aanwezig is in een gegeven massa van de verbinding.
Kaliumfosfaat molaire massa
De molmassa van K3PO4 bedraagt 212,27 g/mol. Het wordt berekend door de atoommassa’s van kalium, fosfor en zuurstof aan de verbinding toe te voegen. Molaire massa is een belangrijke parameter voor het bepalen van de hoeveelheid stof die aanwezig is in een bepaalde massa van de verbinding. Het is ook nuttig voor het berekenen van de stoichiometrie van reacties waarbij K3PO4 betrokken is.
Kookpunt van kaliumfosfaat
Het kookpunt van K3PO4 bedraagt 1660°C. Dit hoge kookpunt is te wijten aan de sterke ionische bindingen tussen de K+-ionen en de PO43–ionen in de verbinding. Het is ook een indicatie van de stabiliteit van de verbinding bij hoge temperaturen. Het kookpunt van K3PO4 is bruikbaar in diverse industriële toepassingen, zoals bij de productie van keramiek en glas.
Smeltpunt van kaliumfosfaat
Het smeltpunt van K3PO4 is 1340°C. Dit is de temperatuur waarbij de vaste verbinding overgaat in de vloeibare toestand. Het hoge smeltpunt van K3PO4 is te wijten aan de ionische aard van de verbinding, die een grote hoeveelheid energie vereist om de aantrekkingskracht tussen de ionen te overwinnen. Het smeltpunt van K3PO4 is nuttig bij het bepalen van de geschiktheid ervan voor verschillende toepassingen, zoals de productie van meststoffen en voedseladditieven.
Dichtheid van kaliumfosfaat g/ml
De dichtheid van K3PO4 is 2,564 g/ml bij kamertemperatuur. De hoge dichtheid van de verbinding is te danken aan de aanwezigheid van drie K+-ionen en één PO43-ion in elke formule-eenheid. De dichtheid van K3PO4 is nuttig bij het bepalen van de oplosbaarheid en het gedrag ervan in verschillende industriële processen, zoals bij de productie van meststoffen en voedseladditieven.
Kaliumfosfaat Molecuulgewicht
Het molecuulgewicht van K3PO4 bedraagt 212,27 g/mol. Het is de som van de atoomgewichten van alle atomen in de verbinding. Het molecuulgewicht is nuttig voor het berekenen van de hoeveelheid stof die aanwezig is in een gegeven massa van de verbinding, en voor het bepalen van de stoichiometrie van reacties waarbij K3PO4 betrokken is.
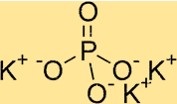
Structuur van kaliumfosfaat
K3PO4 heeft een orthorhombische kristalstructuur. Het bestaat uit een reeks PO4-tetraëders, waarbij elk fosfaation twee zuurstofatomen deelt met aangrenzende fosfaationen. Kaliumionen bevinden zich tussen fosfaattetraëders, omgeven door zuurstofatomen. De structuur van K3PO4 is nuttig voor het begrijpen van de eigenschappen ervan, zoals de oplosbaarheid en thermische stabiliteit.
| Verschijning | Wit kristallijn poeder |
| Specifieke dichtheid | 2.564 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 212,27 g/mol |
| Dikte | 2.564 g/ml |
| Fusie punt | 1340°C |
| Kookpunt | 1660°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 100 g/l (20°C) |
| Oplosbaarheid | Oplosbaar in ethanol en aceton, onoplosbaar in ether |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH | De pH van een 1%-oplossing is 11,5 |
Kaliumfosfaatveiligheid en gevaren
K3PO4 wordt over het algemeen als veilig in gebruik beschouwd als het op de juiste manier wordt behandeld. Zoals elke chemische stof kan het echter gevaren opleveren als het verkeerd wordt gebruikt of in grote hoeveelheden wordt ingenomen. De verbinding is geclassificeerd als irriterend voor de huid, de ogen en de luchtwegen en kan ernstige brandwonden of ademhalingsproblemen veroorzaken als deze in hoge concentraties wordt ingeademd of ingeslikt. Het is ook onverenigbaar met zuren en oxidatiemiddelen en kan brand of explosies veroorzaken bij blootstelling aan deze materialen. Daarom is het belangrijk om voorzichtig om te gaan met K3PO4, geschikte beschermende uitrusting te dragen en het op te slaan in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. |
| VN-identificatienummers | UN 2833 (voor watervrij), UN 2423 (voor trihydraat) |
| HS-code | 28352400 |
| Gevarenklasse | 6.1 (giftig) |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat): 2.340 mg/kg; LC50 (inhalatie, rat): 50 mg/l |
Methoden voor de synthese van kaliumfosfaat (K3PO4)
Er bestaan verschillende methoden om K3PO4 te synthetiseren, waaronder de reactie van fosforzuur (H3PO4) met kaliumhydroxide (KOH) of de thermische ontleding van KH2PO4.
Eén methode omvat het laten reageren van equimolaire hoeveelheden KOH en H3PO4 in water bij een temperatuur van ongeveer 60 tot 80°C. De procedure omvat het verdampen van het resulterende mengsel en het verwarmen van het vaste residu tot ongeveer 300°C om K3P04 te produceren.
Een andere methode is om KH2PO4 te laten reageren met KOH bij hoge temperatuur (boven 400°C) om K3PO4 en water te produceren. Een gespecialiseerde oven kan dit proces uitvoeren dat thermische ontleding wordt genoemd.
De reactie van fosforzuur met kaliumcarbonaat (K2CO3) en de reactie van kaliumoxide (K2O) met fosforpentoxide (P2O5) zijn aanvullende methoden voor de productie van K3PO4.
Gebruik van kaliumfosfaat
K3PO4 heeft verschillende praktische toepassingen in een reeks industrieën, waaronder:
- Meststof: Wordt vaak gebruikt als meststof vanwege het hoge fosforgehalte. Boeren voegen het vaak toe aan de bodem om essentiële voedingsstoffen aan planten te leveren.
- Voedingsindustrie: Gebruikt als voedingsadditief om de zuurgraad te reguleren, verkleuring te voorkomen en de textuur te verbeteren.
- Buffermiddel: Diverse laboratoriumtoepassingen gebruiken het als een effectief buffermiddel, waaronder pH-kalibratiebufferoplossingen en biologisch onderzoek.
- Wasmiddelen: Wordt gebruikt bij de productie van wasmiddelen en schoonmaakproducten vanwege het vermogen om water te verzachten en de opbouw van minerale afzettingen te voorkomen.
- Geneeskunde: Gebruikt als voedingssupplement om bepaalde medische aandoeningen te behandelen, zoals lage fosfaatwaarden in het bloed.
- Waterbehandeling: Gebruikt bij waterbehandeling om de vorming van aanslag en corrosie in leidingen en apparatuur te voorkomen.
- Vlamvertrager: Wordt gebruikt als vlamvertrager in verschillende materialen, waaronder textiel en kunststoffen, vanwege het vermogen om waterdamp vrij te geven en de verspreiding van vlammen te voorkomen.
Vragen:
Vraag: Is kaliumfosfaat oplosbaar in water?
A: Ja, K3PO4 is oplosbaar in water.
Vraag: Hoeveel kaliumionen zijn er nodig om zich aan een fosfaation te binden?
A: Er zijn drie kaliumionen nodig om zich aan een fosfaation te binden en K3PO4 te vormen.
Vraag: Welk neerslag ontstaat er wanneer waterige oplossingen van calciumbromide en kaliumfosfaat worden gemengd?
A: Wanneer waterige oplossingen van calciumbromide en K3PO4 worden gemengd, wordt een neerslag van calciumfosfaat (Ca3(PO4)2) gevormd.
Vraag: Is k3po4 oplosbaar in water?
A: Ja, K3PO4 is oplosbaar in water.
Vraag: Is k3po4 oplosbaar?
A: Ja, K3PO4 is oplosbaar in water.
Vraag: Welke producten ontstaan uit het mengen van waterige oplossingen van Ni(C2H3O2)2 (aq) en K3PO4 (aq)?
A: Wanneer waterige oplossingen van Ni(C2H3O2)2 en K3PO4 worden gemengd, vormt zich een neerslag van nikkel(II)fosfaat (Ni3(PO4)2), evenals waterige oplossingen van kaliumacetaat (KCH3COO) en azijnzuur (CH3COOH).
Vraag: Welk element verhoogt zijn oxidatiegetal in deze reactie? 3KOH + H3PO4 → K3PO4 + 3H2O
A: Het element fosfor verhoogt zijn oxidatiegetal van +5 in H3PO4 naar +5 in K3PO4.
Vraag: Wat is K3PO4?
A: K3PO4 is de chemische formule voor kaliumfosfaat, een verbinding die in verschillende toepassingen wordt gebruikt, zoals meststoffen, voedseladditieven en schoonmaakproducten.
