n-pentaan is een koolwaterstof met de molecuulformule C5H12. Het wordt gebruikt als oplosmiddel, brandstof en blaasmiddel voor schuimisolatie. Het kookpunt is 36°C.
| IUPAC-naam | Pentaan |
| Moleculaire formule | C5H12 |
| CAS-nummer | 109-66-0 |
| Synoniemen | n-Amylhydride, Skellysolve A, amylhydride, pentylhydride, UN 1265 |
| InChi | InChI=1S/C5H12/c1-3-5-4-2/h3-5H2.1-2H3 |
Eigenschappen van n-pentaan
Kookpunt van pentaan
Pentaan heeft een kookpunt van 36,07°C (97,13°F) bij standaarddruk (1 atm). Het is een vluchtige en brandbare vloeistof die gemakkelijk verdampt bij kamertemperatuur. Het lage kookpunt maakt het bruikbaar als blaasmiddel voor isolatieschuim en als brandstof voor verbrandingsmotoren.
Pentaan formule
De chemische formule voor pentaan is C5H12. Het is een alkaan met rechte keten en behoort tot de koolwaterstofgroep. De formule geeft het aantal en het type atomen aan dat aanwezig is in een pentaanmolecuul. De formule van pentaan is belangrijk bij het bepalen van het gedrag ervan in verschillende toepassingen, zoals de reactiviteit met andere stoffen.
Molaire massa van pentaan
De molaire massa van pentaan, ook wel normaal pentaan genoemd, is 72,15 g/mol. Het is een alkaan met een rechte keten en heeft vijf koolstofatomen en twaalf waterstofatomen. De molaire massa wordt berekend door de atoomgewichten van koolstof en waterstof in het molecuul op te tellen. De molmassa van pentaan is belangrijk bij het bepalen van de hoeveelheid verbinding die nodig is bij verschillende chemische reacties.
Smeltpunt van pentaan
Pentaan heeft een smeltpunt van -129,8°C (-201,6°F). Het is een kleurloze vloeistof bij kamertemperatuur en druk, maar kan bij lage temperaturen bevriezen tot een vaste stof. Het smeltpunt van pentaan is belangrijk bij het bepalen van het gedrag ervan in verschillende toepassingen, zoals koeling en warmteoverdracht.
Dichtheid van pentaan g/ml
De dichtheid van pentaan is 0,63 g/ml bij 20°C. Het is een vloeistof met een lagere dichtheid dan water en drijft op het wateroppervlak. De dichtheid van pentaan is belangrijk bij het bepalen van het gedrag ervan bij verschillende toepassingen, zoals het mengen met andere vloeistoffen en de geschiktheid ervan als brandstof.
Molecuulgewicht van pentaan
Het molecuulgewicht van pentaan is 72,15 g/mol. Het is de som van de atoomgewichten van alle atomen in een pentaanmolecuul. Het molecuulgewicht van pentaan is belangrijk bij het bepalen van het gedrag ervan bij verschillende toepassingen, zoals de oplosbaarheid ervan in verschillende oplosmiddelen.
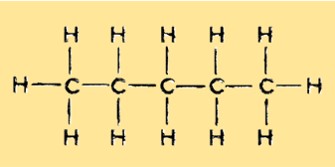
Structuur van pentaan
Pentaan heeft een lineaire, onvertakte structuur met vijf koolstofatomen en 12 waterstofatomen. Het is een verzadigde koolwaterstof en behoort tot de alkaangroep. Elk koolstofatoom is gebonden aan twee waterstofatomen, behalve de twee terminale koolstofatomen die gebonden zijn aan drie waterstofatomen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,626 – 0,63 bij 20°C |
| Kleur | Kleurloos |
| Geur | Geur van benzine |
| Molaire massa | 72,15 g/mol |
| Dikte | 0,63 g/ml bij 20°C |
| Fusie punt | -129,8°C (-201,6°F) |
| Kookpunt | 36,07°C (97,13°F) |
| Flitspunt | -49°C (-56,2°F) |
| oplosbaarheid in water | 17,5 mg/l bij 20°C |
| Oplosbaarheid | Onoplosbaar in water, oplosbaar in organische oplosmiddelen |
| Dampdruk | 380 mmHg bij 25°C |
| Dampdichtheid | 2,5 (lucht=1) |
| pKa | ~45 |
| pH | Niet toepasbaar |
Veiligheid en gevaren van n-pentaan
N-pentaan is een brandbare vloeistof en kan met lucht explosieve mengsels vormen. Het brengt brand- en explosiegevaar met zich mee en moet met zorg worden behandeld. Het kan irritatie aan de ogen, huid en luchtwegen veroorzaken, en langdurige blootstelling kan duizeligheid en hoofdpijn veroorzaken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te gebruiken bij het hanteren van n-Pentaan. Gebruik in geval van brand geschikte blusmiddelen, zoals kooldioxide of droog chemisch poeder. Het is ook belangrijk om n-Pentane op te slaan in een koele, goed geventileerde ruimte en uit de buurt van ontstekingsbronnen.
| Gevarensymbolen | F, Xi |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Gebruik uitsluitend vonkvrij gereedschap. Houd de container goed gesloten. Adem geen dampen in. Vermijd contact met ogen, huid en kleding. Alleen in een goed geventileerde ruimte gebruiken. In geval van brand geschikte blusmiddelen gebruiken. |
| VN-identificatienummers | VN1265 |
| HS-code | 2901.10.00 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Kan irritatie aan ogen, huid en luchtwegen veroorzaken. Langdurige blootstelling kan duizeligheid en hoofdpijn veroorzaken. |
Methoden voor de synthese van n-pentaan
Olieraffinage is de belangrijkste methode voor de productie van n-pentaan. Het is een koolwaterstof met een rechte keten en een van de hoofdbestanddelen van benzine. Er zijn verschillende methoden voor de synthese van n-Pentaan:
Het kraken van olie: Om n-pentaan uit olie te verkrijgen, kunnen we het kraken met behulp van gefractioneerde destillatie, een proces waarbij ruwe olie wordt verwarmd om de componenten ervan te scheiden op basis van hun kookpunt. Vervolgens kunnen we n-pentaan scheiden van andere koolwaterstoffen waarvan het kookpunt tussen de 30 en 40°C ligt.
Isomerisatie: Isomerisatie is het proces waarbij één koolwaterstof wordt omgezet in een andere formule met hetzelfde molecuul maar een andere structuur. De isomerisatie van pentenen produceert n-pentaan als bijproduct. De petrochemische industrie maakt veelvuldig gebruik van deze methode.
Hydrogenering: Penteenhydrogenering is een andere methode voor het synthetiseren van n-pentaan. Om n-pentaan uit pentenen te synthetiseren, kunnen we reageren met waterstofgas in aanwezigheid van een katalysator, meestal een metaal zoals nikkel of platina. De reactie produceert n-pentaan als bijproduct.
Dehydratie van 1-pentanol: Men kan ook n-pentaan synthetiseren uit 1-pentanol door het te dehydrateren met behulp van een zure katalysator zoals zwavelzuur . Bij deze reactie ontstaat n-penteen, dat vervolgens kan worden gehydrogeneerd om n-pentaan te verkrijgen.
Gebruik van n-pentaan
N-pentaan heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de belangrijkste toepassingen:
- Oplosmiddel: Gebruikt als oplosmiddel voor oliën, was en harsen in de verf- en coatingindustrie. Lijmen, inkten en rubber gebruiken het als oplosmiddel.
- Blaasmiddel: gebruikt als blaasmiddel bij de productie van schuimisolatie, zoals geëxpandeerd polystyreen (EPS) en geëxtrudeerd polystyreen (XPS).
- Chemisch tussenproduct: Gebruikt als chemisch tussenproduct bij de productie van andere chemicaliën, zoals pentanol, pentaanzuur en pentanal.
- Brandstof: Wordt gebruikt als brandstof in sommige benzinemengsels, meestal als mengcomponent om het octaangetal te verhogen.
- Kalibratiestandaard: gebruikt als kalibratiestandaard bij gaschromatografie.
- Extractie: Gebruikt bij de extractie van eetbare oliën, zoals sojaolie, en bij de extractie van natuurlijke producten, zoals essentiële oliën uit planten.
- Laboratoriumonderzoek: Gebruikt in laboratoriumonderzoek als oplosmiddel en als referentiemateriaal voor gaschromatografie.
Vragen:
Vraag: De molecuulformule voor pentaan is c5h12. wat is de molecuulformule van een pentaan-isomeer?
A: 2-Methylbutaan (ook bekend als isopentaan) heeft de molecuulformule C5H12 en is een isomeer van pentaan.
Vraag: Is pentaan polair?
A: Nee, pentaan is niet-polair omdat het alleen niet-polaire koolstof-koolstof- en koolstof-waterstofbindingen bevat en een symmetrische moleculaire vorm heeft.
Vraag: Welke van de volgende stoffen is het meest oplosbaar in water? azijnzuur pentanol butaanzuur pentanal
A: Azijnzuur is het meest oplosbaar in water vanwege zijn vermogen om waterstofbruggen te vormen met watermoleculen.
Vraag: Is pentaan oplosbaar in water?
A: Nee, pentaan is onoplosbaar in water vanwege zijn niet-polaire aard en zijn onvermogen om waterstofbruggen te vormen met watermoleculen.
Vraag: Heeft n-pentaan een waterstofbrug?
A: Nee, n-pentaan heeft geen waterstofbinding omdat het geen waterstofatomen bevat die gebonden zijn aan elektronegatieve atomen zoals zuurstof, stikstof of fluor.
