Magnesiumchloride (MgCl2) is een verbinding bestaande uit magnesium- en chloride-ionen. Het wordt vaak gebruikt als supplement om magnesiumtekort te behandelen en als ontdooimiddel voor wegen en trottoirs.
| IUPAC-naam | Magnesium chloride |
| Moleculaire formule | MgCl2 |
| CAS-nummer | 7786-30-3 |
| Synoniemen | Magnesiumdichloride, chloormagnesiet, bischloormagnesium, magnesium (II) chloride, E511, Nigari |
| InChi | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Magnesiumchloride-formule
De chemische formule voor magnesiumchloride is MgCl2. Deze formule geeft aan dat magnesiumchloride bestaat uit één Mg+2-ion en twee Cl-ionen. De formule is belangrijk bij het bepalen van de hoeveelheid magnesiumchloride die nodig is voor chemische reacties. Magnesiumchloride wordt vaak gebruikt als supplement om magnesiumtekort te behandelen en als ontdooimiddel voor wegen en trottoirs.
Molaire massa magnesiumchloride
De molmassa van magnesiumchloride is 95,21 g/mol. Het is een kristallijne verbinding bestaande uit één Mg+2-ion en twee Cl-ionen. Molaire massa is een belangrijke eigenschap van magnesiumchloride omdat het wordt gebruikt om de hoeveelheid stof in chemische reacties te berekenen. Magnesiumchloride wordt vaak gebruikt als supplement om magnesiumtekort te behandelen en als ontdooimiddel voor wegen en trottoirs.
Kookpunt van MgCl2
MgCl2 heeft een hoog kookpunt van 1.412°C, wat betekent dat het veel energie nodig heeft om de bindingen tussen zijn atomen en moleculen te verbreken. Deze eigenschap maakt het bruikbaar bij toepassingen bij hoge temperaturen, zoals bij de productie van metalen en legeringen. MgCl2 wordt ook gebruikt als droogmiddel om vocht uit de lucht te absorberen en als katalysator bij chemische reacties.
Smeltpunt van MgCl2
Het smeltpunt van MgCl2 is 714°C, wat betekent dat het bij kamertemperatuur een vaste stof is. Deze eigenschap maakt het bruikbaar in verschillende toepassingen, zoals de productie van magnesiummetaal en als vloeimiddel bij het lassen van aluminium. MgCl2 wordt ook gebruikt als stollingsmiddel bij de productie van tofu en andere sojaproducten.
Dichtheid MgCl2 g/ml
De dichtheid van MgCl2 bedraagt 2,32 g/ml. Deze eigenschap maakt het bruikbaar in verschillende toepassingen, zoals de productie van vlamvertragende materialen en de behandeling van afvalwater. MgCl2 wordt ook gebruikt als stofonderdrukker op wegen en in de snelwegaanleg.
Molecuulgewicht van MgCl2
Het molecuulgewicht van MgCl2 is 95,21 g/mol. Deze eigenschap is belangrijk voor het bepalen van de hoeveelheid MgCl2 die nodig is voor chemische reacties. MgCl2 wordt vaak gebruikt als supplement om magnesiumtekort te behandelen en als ontdooimiddel voor wegen en trottoirs.
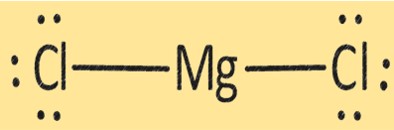
MgCl2-structuur
MgCl2 heeft een kristalstructuur bestaande uit één Mg+2-ion en twee Cl-ionen. De structuur van MgCl2 is belangrijk bij het bepalen van de fysische en chemische eigenschappen ervan. MgCl2 wordt in verschillende toepassingen gebruikt, zoals de productie van magnesiummetaal, als droogmiddel en als stollingsmiddel bij de productie van tofu en andere sojaproducten.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,32 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 95,21 g/mol |
| Dikte | 2,32 g/ml |
| Fusie punt | 714°C |
| Kookpunt | 1412°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, ethanol, methanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 7,6 (voor Mg(H2O)6^2+ ionen) |
| pH | 6,0 – 8,0 |
Veiligheid en gevaren van magnesiumchloride
Magnesiumchloride (MgCl2) wordt over het algemeen als veilig beschouwd als het wordt gebruikt zoals voorgeschreven. Het kan echter enkele gevaren met zich meebrengen als het niet op de juiste manier wordt behandeld. Het kan irritatie van de huid en ogen veroorzaken en het inademen van stof kan ademhalingsproblemen veroorzaken. Het innemen van grote hoeveelheden MgCl2 kan misselijkheid, braken en diarree veroorzaken. Het kan ook schadelijk zijn voor het waterleven als het in de waterwegen terechtkomt. Bij het hanteren van MgCl2 moeten geschikte beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gedragen. Eventuele lekkages of lekkages moeten onmiddellijk worden ingedamd en opgeruimd om schade aan het milieu te voorkomen.
| Gevarensymbolen | Geen toegewezen |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. In geval van contact, afspoelen met water. Draag handschoenen en een veiligheidsbril bij het hanteren. |
| VN-identificatienummers | EEN 2019 |
| HS-code | 28273100 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat) – 4.640 mg/kg; LC50 (inhalatie, rat) – >4,4 mg/l gedurende 4 uur |
Synthesemethoden voor magnesiumchloride
Verschillende methoden kunnen MgCl2 synthetiseren, waaronder directe synthese, reactie met zoutzuur en reactie met MgO.
Om MgCl2 te produceren door directe synthese, verbrand je magnesiummetaal in lucht of chloorgas om MgO te creëren. Laat MgO vervolgens reageren met zoutzuur om MgCl2 te produceren:
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Een andere methode omvat het laten reageren van metallisch Mg met zoutzuur om MgCl2 en waterstofgas te produceren:
Mg + 2HCl → MgCl2 + H2
Voor de reactie met MgO mengen we MgO met zoutzuur om MgCl2 en water te produceren:
MgO + 2HCl → MgCl2 + H2O
Het mengen van MgO met zoutzuur produceert magnesiumchloride en water bij reactie met MgO:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Bovendien kunnen we MgCl2 verkrijgen als bijproduct van het Solvay-proces, dat natriumcarbonaat produceert. Het proces resulteert in de productie van calciumchloride en MgCl2 als bijproducten, die kunnen worden gescheiden van de natriumcarbonaatoplossing.
Gebruik van magnesiumchloride
Magnesiumchloride heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Ontijzingsmiddel: Wordt gebruikt als ontijzingsmiddel op wegen en trottoirs tijdens de wintermaanden vanwege het vermogen om het vriespunt van water te verlagen.
- Stofbestrijding: Gebruikt als stofbestrijdingsmiddel op onverharde wegen en bouwplaatsen.
- Voedingsindustrie: Gebruikt als stollingsmiddel bij de productie van tofu en als bron van magnesium in bepaalde voedingsproducten.
- Geneeskunde: Medicinaal gebruikt als aanvulling op magnesiumtekort en als behandeling voor bepaalde aandoeningen, zoals constipatie en brandend maagzuur.
- Landbouw: Gebruikt als meststof en bodemverbeteraar om het magnesiumgehalte van de bodem en plantengroei te verbeteren.
- Waterbehandeling: Gebruikt in waterbehandelingsprocessen om onzuiverheden te verwijderen en hard water te verzachten.
- Industriële toepassingen: Gebruikt bij de productie van textiel, papier en cement, maar ook bij verschillende industriële processen.
- Gezondheid en welzijn: Gebruikt in verschillende gezondheids- en welzijnspraktijken, zoals baden, om ontspanning te bevorderen en de gezondheid van de huid te verbeteren.
Vragen:
Vraag: Wat is de formule voor magnesiumchloride?
A: De formule voor magnesiumchloride is MgCl2.
Vraag: Wat is magnesiumchloride?
A: MgCl2 is een anorganische verbinding die vaak wordt gebruikt in verschillende industrieën en toepassingen, waaronder als ontijzingsmiddel, stofbestrijdingsmiddel en voedseladditief.
Vraag: Is magnesiumchloride oplosbaar?
A: Ja, MgCl2 is oplosbaar in water en andere polaire oplosmiddelen.
Vraag: Is magnesiumchloride ionisch of covalent?
A: MgCl2 is een ionische verbinding bestaande uit een kation (Mg2+) en een anion (Cl-).
Vraag: Wat is MgCl2?
A: MgCl2 is de chemische formule voor magnesiumchloride, een anorganische verbinding die wordt gebruikt in verschillende industriële en consumententoepassingen.
Vraag: Wat is de netto ionische vergelijking voor de reactie van MgCl2 met NaOH?
A: De netto ionische vergelijking voor de reactie van MgCl2 met NaOH is Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s).
