Calciumnitraat is een chemische verbinding met de formule Ca(NO3)2. Het is een kleurloze en geurloze vaste stof die zeer oplosbaar is in water. Calciumnitraat wordt vaak gebruikt als meststof en bij de behandeling van afvalwater. Het wordt ook gebruikt bij de productie van beton, als onderdeel van explosieven en bij de vervaardiging van diverse andere chemicaliën.
| IUPAC-naam | Calciumdinitraat |
| Moleculaire formule | Ca(NO3)2 |
| CAS-nummer | 10124-37-5 |
| Synoniemen | Calciumnitraattetrahydraat, calciumzout van salpeterzuur, nitrocalciet, Noorse salpeter, kalksalpeter, Norgessalpeter |
| InChi | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Calciumnitraatformule
De formule voor calciumnitraat is Ca(NO3)2. Dit betekent dat elke eenheid calciumnitraat één calciumion (Ca²⁺) en twee nitraationen (NO3⁻) bevat. De calciumnitraatformule wordt vaak gebruikt om de molaire massa en andere eigenschappen van de verbinding te bepalen.
Molaire massa calciumnitraat
Calciumnitraat heeft een molaire massa van 164.088 g/mol. Het is een zout bestaande uit Ca+2- en NO3-ionen, met de formule Ca(NO3)2. De molaire massa van een verbinding is de massa in grammen van één mol van die formuleverbinding, die gelijk is aan het gewicht ervan. In het geval van Ca(NO3)2 is het formulegewicht de som van de atoomgewichten van alle atomen in de verbinding.
Kookpunt van calciumnitraat
Ca(NO3)2 heeft een relatief hoog kookpunt van 132 graden Celsius. Dit betekent dat het een aanzienlijke hoeveelheid energie kost om de vaste verbinding in een gas om te zetten. Het hoge kookpunt van Ca(NO3)2 is te wijten aan zijn ionische aard, wat resulteert in sterke elektrostatische interacties tussen Ca+2 en NO3-ionen.
Smeltpunt van calciumnitraat
Het smeltpunt van Ca(NO3)2 is 561 graden Celsius. Dit is relatief hoog voor een zout en weerspiegelt nogmaals de sterke ionische interacties tussen Ca+2- en NO3–ionen. Het smeltpunt van Ca(NO3)2 maakt het een bruikbare verbinding voor toepassingen bij hoge temperaturen, zoals bij de productie van kunstmest of explosieven.
Dichtheid van calciumnitraat g/ml
De dichtheid van Ca(NO3)2 varieert afhankelijk van de vorm. De dichtheid van watervrij Ca(NO3)2 is bijvoorbeeld ongeveer 2,5 g/cm³, terwijl de dichtheid van tetrahydraat (Ca(NO3)2.4H2O) ongeveer 1,82 g/cm³ is. Deze waarden maken Ca(NO3)2 tot een relatief dichte verbinding vergeleken met veel andere zouten.
Calciumnitraat Molecuulgewicht
Het molecuulgewicht van Ca(NO3)2 bedraagt 164,088 g/mol. Deze waarde is de som van de atoomgewichten van alle atomen in de verbinding, waaronder twee stikstofatomen, zes zuurstofatomen en één calciumatoom.
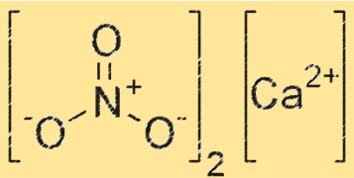
Structuur van calciumnitraat
Ca(NO3)2 heeft een ionische structuur, waarbij het calciumion (Ca²⁺) omgeven is door zes zuurstofatomen in een octaëdrische opstelling. Het NO3-ion is ook aanwezig in het kristalrooster, waarbij elk zuurstofatoom van het NO3-ion een coördinatiebinding vormt met het Ca+2-ion. De structuur van Ca(NO3)2 is vergelijkbaar met die van andere ionische verbindingen, zoals natriumchloride.
| Verschijning | Witte kristallen of poeder |
| Soortelijk gewicht | 2,5 (watervrij); 1,82 (tetrahydraat) |
| Kleur | Kleurloos (watervrij); Wit (tetrahydraat) |
| Geur | Geurloos |
| Molaire massa | 164.088 g/mol |
| Dikte | 2,5 g/cm³ (watervrij); 1,82 g/cm³ (tetrahydraat) |
| Fusie punt | 561°C (watervrij); 45°C (tetrahydraat) |
| Kookpunt | 132°C (ontleedt) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 121,2 g/100 ml (0°C); 126,7 g/100 ml (20°C); 179,6 g/100 ml (100 °C) |
| Oplosbaarheid | Oplosbaar in water, ethanol, methanol |
| Dampdruk | Verwaarloosbaar (watervrij) |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | 4,5-7,5 (10% oplossing) |
Veiligheid en gevaren van calciumnitraat
Calciumnitraat (Ca(NO3)2) kan verschillende gevaren opleveren als er niet op de juiste manier mee wordt omgegaan. Het is een sterk oxidatiemiddel dat brand of explosies kan veroorzaken als het in contact komt met brandbare materialen. De verbinding kan bij contact ook huid- en oogirritatie veroorzaken, en het inademen van stof kan irritatie van de luchtwegen veroorzaken. Ca(NO3)2 moet op een koele, droge plaats worden bewaard, uit de buurt van warmtebronnen, en mag niet zonder passende voorzorgsmaatregelen met andere chemicaliën worden gemengd. Bij het hanteren van Ca(NO3)2 moeten persoonlijke beschermingsmiddelen zoals handschoenen en oogbescherming worden gedragen om contact met de huid of ogen te vermijden. In geval van accidentele inname moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Oxidatiemiddel (GHS05), Irriterend (GHS07) |
| Beveiligingsbeschrijving | S22: Stof/rook/gas/nevel/damp/aërosolen niet inademen. S26: Bij aanraking met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| AN-identificaties | UN1454 (watervrij calciumnitraat), UN1455 (calciumnitraat tetrahydraat) |
| HS-code | 283429 |
| Gevarenklasse | 5.1 (Oxidatiemiddelen) |
| Verpakkingsgroep | III |
| Toxiciteit | Oraal (LD50): 3.420 mg/kg (rat); Dermaal (LD50): > 5.000 mg/kg (konijn); Inhalatie (LC50): >4,8 mg/l/4u (rat) |
Synthesemethoden voor calciumnitraat
Er zijn verschillende methoden om Ca(NO3)2 te synthetiseren, afhankelijk van de specifieke toepassing en gewenste zuiverheid.
Een gebruikelijke methode is het laten reageren van calciumcarbonaat met salpeterzuur, waarbij Ca(NO3)2 en kooldioxide worden geproduceerd:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Een andere methode is om calciumhydroxide te laten reageren met salpeterzuur :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
De reactie tussen salpeterzuur en calciumoxide geeft Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
Het resulterende Ca(NO3)2 kan verder worden gezuiverd door herkristallisatie of door een kleine hoeveelheid zwavelzuur toe te voegen om onzuiverheden zoals ijzer en aluminium te verwijderen.
Fabrikanten kunnen Ca(NO3)2 produceren door calciummetaal te laten reageren met salpeterzuur of door calciumhydroxide te laten reageren met ammoniumnitraat. Ze gebruiken deze methoden echter minder vaak vanwege de hogere kosten of veiligheidsproblemen die gepaard gaan met reactieve metalen of ammoniumnitraat.
Gebruik van calciumnitraat
- Gebruikt als meststof in de landbouw om planten te voorzien van calcium- en stikstofvoedingsstoffen voor groei.
- Gebruikt als onderdeel van verschillende soorten beton en cement om hun sterkte en duurzaamheid te verbeteren.
- Gebruikt als additief bij de productie van chemicaliën voor de behandeling van afvalwater om fosfor- en stikstofverbindingen uit water te helpen verwijderen.
- Gebruikt bij de productie van verschillende soorten explosieven en vuurwerk vanwege de oxiderende eigenschappen.
- Gebruikt als bron van calcium en stikstof bij de productie van verschillende chemicaliën zoals nylon en andere synthetische vezels.
- Gebruikt als corrosieremmer voor metalen zoals aluminium en staal in industriële toepassingen.
- Gebruikt bij het conserveren van vlees en als voedingsadditief om de kwaliteit van bepaalde voedingsproducten te verbeteren.
- Gebruikt bij de productie van rookbommen en fakkels voor militaire en civiele toepassingen.
- Gebruikt bij de vervaardiging van bepaalde meststoffen. Wordt ook gebruikt in combinatie met andere verbindingen om te zorgen voor een evenwichtige toevoer van voedingsstoffen naar gewassen.
- Wordt gebruikt als onderdeel van bepaalde speciale aquariummeststoffen om waterplanten van essentiële voedingsstoffen te voorzien.
Vragen:
Vraag: Wat is de naam van Ca(NO3)2?
A: De naam van Ca(NO3)2 is calciumnitraat.
Vraag: Is Ca(NO3)2 oplosbaar in water?
A: Ja, Ca(NO3)2 is zeer goed oplosbaar in water. Bij kamertemperatuur kan 100 gram water tot 121 gram calciumnitraat oplossen.
Vraag: Waar kan ik calciumnitraat kopen?
A: Ca(NO3)2 kan worden gekocht bij verschillende chemische leveranciers, online en in winkels. Enkele veel voorkomende plaatsen waar u Ca(NO3)2 kunt kopen zijn onder meer wetenschappelijke toeleveringsbedrijven, winkels voor landbouwbenodigdheden en huis- en tuincentra. Het is belangrijk om ervoor te zorgen dat de leverancier een goede reputatie heeft en dat het product van hoge kwaliteit is en geschikt is voor de beoogde toepassing.
