Natriumsulfaat is een witte kristallijne verbinding met de formule Na2SO4. Het wordt gebruikt in de wasmiddelen-, papier- en glasindustrie als vulmiddel, droogmiddel en ontschuimer.
| IUPAC-naam | Dinatriumsulfaat |
| Moleculaire formule | Na2SO4 |
| CAS-nummer | 7757-82-6 |
| Synoniemen | Dinatriumsulfaat, watervrij natriumsulfaat, natriumsulfaat |
| InChi | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 molaire massa
Natriumsulfaat heeft een molaire massa van 142,04 g/mol. Het is een ionische verbinding bestaande uit twee natriumkationen (Na+) en een sulfaatanion (SO42-). De molaire massa wordt berekend door de atoommassa’s van alle atomen in een natriumsulfaatmolecuul op te tellen. In dit geval hebben we twee natriumatomen met een massa van elk 22,99 g/mol, één zwavelatoom met een massa van 32,06 g/mol en vier zuurstofatomen met een massa van elk 15,99 g/mol. Als we ze bij elkaar optellen, krijgen we de molaire massa van natriumsulfaat.
Kookpunt van natriumsulfaat
Natriumsulfaat heeft een hoog kookpunt van 1429 ° C (2604 ° F). Dit komt door de ionische aard van de verbinding, die sterke elektrostatische aantrekkingskrachten creëert tussen de positief geladen natriumionen en de negatief geladen sulfaationen. Om deze krachten te overwinnen is een grote hoeveelheid energie nodig. Daarom is het kookpunt van natriumsulfaat zo hoog.
Smeltpunt van natriumsulfaat
Het smeltpunt van natriumsulfaat varieert afhankelijk van het watergehalte. Watervrij natriumsulfaat (zonder water) heeft een smeltpunt van 884°C (1.623°F). Natriumsulfaatdecahydraat (met tien watermoleculen) smelt echter bij een lagere temperatuur van 32,4°C (90,3°F). De aanwezigheid van watermoleculen in de kristalstructuur van natriumsulfaatdecahydraat verzwakt de ionische bindingen tussen natrium- en sulfaationen, waardoor het smeltpunt wordt verlaagd.
Dichtheid van natriumsulfaat g/ml
De dichtheid van natriumsulfaat varieert afhankelijk van de vorm. Watervrij natriumsulfaat heeft een dichtheid van 2,664 g/cm3, terwijl natriumsulfaatdecahydraat een dichtheid heeft van 1,464 g/cm3. Het verschil in dichtheid is te wijten aan de aanwezigheid van watermoleculen in de kristalstructuur van het decahydraat, waardoor het volume toeneemt en de dichtheid afneemt.
Natriumsulfaat Molecuulgewicht
Het molecuulgewicht van natriumsulfaat is 142,04 g/mol. Dit is de massa van een natriumsulfaatmolecuul, bestaande uit twee natriumionen en één sulfaation.
Structuur van natriumsulfaat
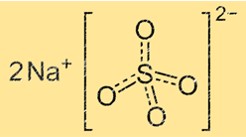
Natriumsulfaat heeft een kristalstructuur die bestaat uit zich herhalende eenheden van natrium- en sulfaationen. Het sulfaation is een tetraëder met vier zuurstofatomen op de hoeken en één zwavelatoom in het midden. Het natriumion is een kleine bol tussen de sulfaationen. De kristalstructuur van natriumsulfaat kan variëren afhankelijk van het watergehalte. Watervrij natriumsulfaat heeft een andere kristalstructuur dan natriumsulfaatdecahydraat.
Natriumsulfaatformule
De chemische formule voor natriumsulfaat is Na2SO4. Dit betekent dat elk molecuul natriumsulfaat twee natriumionen (Na+) en één sulfaation (SO42-) bevat. De formule vertegenwoordigt de eenvoudigste gehele verhouding van atomen in een molecuul van de verbinding.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,664 g/cm3 (watervrij), 1,464 g/cm3 (decahydraat) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 142,04 g/mol |
| Dikte | 2,664 g/cm3 (watervrij), 1,464 g/cm3 (decahydraat) |
| Fusie punt | 884°C (watervrij), 32,4°C (decahydraat) |
| Kookpunt | 1.429°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 44,1 g/100 ml (watervrij), 47,6 g/100 ml (decahydraat) |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in ethanol |
| Dampdruk | 0,01 mmHg bij 20°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1e: 2.01, 2e: 7.20, 3e: 9.41 |
| pH | 9-11 (10% oplossing) |
Veiligheid en gevaren van natriumsulfaat
Natriumsulfaat wordt over het algemeen als veilig in gebruik beschouwd, maar kan onder bepaalde omstandigheden irritatie of schade veroorzaken. Het kan de huid, ogen en luchtwegen irriteren bij contact of inademing. Inslikken van grote hoeveelheden kan misselijkheid, braken en diarree veroorzaken. Het kan ook schadelijk zijn voor het waterleven als het in de waterwegen terechtkomt. Natriumsulfaat wordt niet als brandbaar of explosief materiaal beschouwd. Bij verhitting of blootstelling aan hoge temperaturen kunnen er echter giftige dampen vrijkomen. Het is belangrijk om de juiste hanteringsprocedures te volgen, beschermende uitrusting te dragen en natriumsulfaat op een veilige locatie op te slaan.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S24/25: Vermijd contact met huid en ogen. S36/37: Draag geschikte beschermende kleding en handschoenen. |
| VN-identificatienummers | VN 2118 |
| HS-code | 2833.11.00 |
| Gevarenklasse | Niet gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat): 5.900 mg/kg |
Methoden voor de synthese van natriumsulfaat
Er zijn verschillende methoden voor het synthetiseren van natriumsulfaat, waaronder het laten reageren van natriumchloride met zwavelzuur of het laten reageren van natriumhydroxide met zwavelzuur.
Om natriumsulfaat te produceren, genereert de reactie van natriumchloride en zwavelzuur natriumsulfaat en waterstofchloridegas. Het proces minimaliseert schadelijke dampen door de exotherme reactie onder gecontroleerde omstandigheden uit te voeren. Vervolgens ondergaat de oplossing filtratie vóór verdamping om natriumsulfaatkristallen te produceren.
De synthese van natriumsulfaat omvat ook het combineren van zwavelzuur en natriumhydroxide om natriumsulfaat en water te vormen. De reactie is exotherm en vereist een zorgvuldige behandeling om overlopen te voorkomen. Na filtratie van het mengsel wordt de resulterende oplossing onderworpen aan verdamping, waarbij natriumsulfaatkristallen worden verkregen.
Een andere methode omvat de reactie van natriumcarbonaat met zwavelzuur, waarbij natriumsulfaat, water en kooldioxide worden geproduceerd. Deze methode vereist het gebruik van een zuurkast vanwege het vrijkomen van giftige dampen. De oplossing wordt vervolgens gefiltreerd en ingedampt, waarbij natriumsulfaatkristallen worden verkregen.
Andere industriële processen, zoals de productie van rayon, wasmiddelen en glas, produceren ook natriumsulfaat als bijproduct. Bij deze processen ontstaat natriumsulfaat als afval, dat kan worden gezuiverd en voor andere doeleinden kan worden hergebruikt.
Gebruik van natriumsulfaat
Natriumsulfaat heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Wasmiddelen: Wordt gebruikt als vulstof in waspoeders, waardoor het volume wordt vergroot en de productstroom wordt verbeterd.
- Glas: Gebruikt als vloeimiddel bij de vervaardiging van glas, waardoor het smeltpunt wordt verlaagd en de helderheid van het eindproduct wordt verbeterd.
- Textiel: Wordt gebruikt bij de productie van synthetische vezels, zoals rayon, om de sterkte en duurzaamheid van het materiaal te verbeteren.
- Papier: Wordt gebruikt als pulpmiddel bij de papierproductie en helpt houtvezels af te breken en onzuiverheden te verwijderen.
- Voedsel: Gebruikt als voedingsadditief, voornamelijk als verdikkingsmiddel en emulgator in bewerkte voedingsmiddelen.
- Geneesmiddelen: worden gebruikt bij de productie van bepaalde medicijnen, zoals laxeermiddelen, om constipatie te helpen behandelen.
- Chemicaliën: Gebruikt bij de productie van verschillende chemicaliën, waaronder natriumsulfide, natriumsilicaat en natriumbicarbonaat.
- Waterbehandeling: Gebruikt in waterzuiveringsinstallaties om calcium- en magnesiumionen uit hard water te verwijderen.
- Olieboringen: Wordt bij olieboringen gebruikt als verzwaringsmiddel en helpt de dichtheid van de boorvloeistof onder controle te houden.
Vragen:
Vraag: Wat is de formule voor natriumsulfaat?
A: De chemische formule voor natriumsulfaat is Na2SO4.
Vraag: Wat is natriumsulfaat?
A: Natriumsulfaat is een witte kristallijne vaste stof die vaak wordt gebruikt in een verscheidenheid aan industriële toepassingen, waaronder wasmiddelen, glas, textiel, papier en voedsel.
Vraag: Is natriumsulfaat zuur of basisch?
A: Natriumsulfaat is noch zuur, noch basisch; het is een neutrale verbinding.
Vraag: Welke kleur heeft natriumsulfaat? A: Natriumsulfaat is een witte kristallijne vaste stof en daarom kleurloos.
