Koolzuur (H2CO3) ontstaat wanneer kooldioxide oplost in water en speelt een cruciale rol bij het reguleren van de pH van de oceaan en het beheersen van de verwering van rotsen.
| IUPAC-naam | Koolzuur |
| Moleculaire formule | H2CO3 |
| CAS-nummer | 463-79-6 |
| Synoniemen | Zure lucht; Zure lucht; H2CO3; Oxidaniumylideenmethaan; Zuur carbonaat; hydroxyketon; Dihydroxymethanon |
| InChi | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Koolzuurformule
De chemische formule voor koolzuur is H2CO3, wat aangeeft dat het bestaat uit twee waterstofatomen, één koolstofatoom en drie zuurstofatomen. De formule toont ook de verhouding van atomen in het molecuul, wat belangrijk is voor het bepalen van de stoichiometrie van chemische reacties waarbij koolzuur betrokken is.
Molaire massa koolzuur
De molaire massa van koolzuur is ongeveer 62,03 g/mol. Het is een zwak zuur dat ontstaat wanneer koolstofdioxide oplost in water en verantwoordelijk is voor het reguleren van de pH van de oceanen. De molmassa van koolzuur is belangrijk voor het berekenen van de hoeveelheid zuur die nodig is om een bepaalde pH in een oplossing te bereiken en voor het bepalen hoeveel kooldioxide in water kan oplossen.
Kookpunt van koolzuur
Koolzuur heeft geen duidelijk kookpunt, omdat het uiteenvalt in water en koolstofdioxide voordat het zijn kookpunt bereikt. Bij atmosferische druk ontleedt koolzuur echter bij een temperatuur van ongeveer 333 K (60 ° C) in water en kooldioxide.
Smeltpunt van koolzuur
Koolzuur heeft ook geen goed gedefinieerd smeltpunt, omdat het uiteenvalt in water en kooldioxide voordat het zijn smeltpunt bereikt. Bij atmosferische druk ontleedt koolzuur echter bij een temperatuur van ongeveer 273 K (-0,15 °C) in water en kooldioxide.
Dichtheid van koolzuur g/ml
De dichtheid van koolzuur is ongeveer 1,67 g/ml bij kamertemperatuur (25°C). Deze waarde kan variëren afhankelijk van de concentratie van de oplossing, evenals de temperatuur en druk van de omgeving.
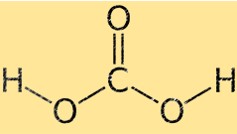
Structuur van koolzuur
Koolzuur heeft een tetraëdrische moleculaire geometrie, met het koolstofatoom in het midden en de vier omringende atomen (twee zuurstofatomen en twee waterstofatomen) op de hoeken van een tetraëder. De twee zuurstofatomen zijn via dubbele bindingen met het koolstofatoom verbonden, terwijl de twee waterstofatomen via enkele bindingen met elkaar verbonden zijn.
Molecuulgewicht van koolzuur
Het molecuulgewicht van koolzuur is 62,03 g/mol. Deze waarde wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen, namelijk waterstof (H), koolstof (C) en zuurstof (O).
| Verschijning | Kleurloze vloeistof of kristallijne vaste stof |
| Soortelijk gewicht | 1,67 g/cm³ |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 62,03 g/mol |
| Dikte | 1,67 g/ml bij kamertemperatuur (25°C) |
| Fusie punt | Ontleedt bij ongeveer 273 K (-0,15 °C) |
| Kookpunt | Ontleedt bij ongeveer 333 K (60°C) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig oplosbaar |
| Oplosbaarheid | Oplosbaar in water, ethanol, methanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 3.6 (eerste dissociatie) |
| pH | 5,6 (in 0,1M-oplossing) |
Koolzuur Veiligheid en gevaren
Koolzuur (H2CO3) wordt over het algemeen als veilig beschouwd, maar kan in bepaalde situaties gevaren met zich meebrengen. Blootstelling aan H2CO3 kan irritatie aan de ogen, huid en luchtwegen veroorzaken en leiden tot hoesten, piepende ademhaling en kortademigheid. Inname van H2CO3 kan maagklachten, misselijkheid en braken veroorzaken. H2CO3 is ook een zwak zuur en kan reageren met bepaalde metalen, zoals aluminium en zink, waardoor brandbaar waterstofgas ontstaat. Bij het hanteren of gebruiken van H2CO3 moeten passende veiligheidsmaatregelen worden genomen, waaronder het dragen van beschermende kleding en voldoende ventilatie. Bij blootstelling moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Niet giftig |
| VN-identificatienummers | Een 1824 |
| HS-code | 28111990 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit |
Koolzuursynthesemethoden
H2CO3 kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke methode is om koolstofdioxide (CO2) te laten reageren met water (H2O) in aanwezigheid van een katalysator. Dit proces, hydratatie genoemd, produceert koolzuur:
CO2 + H2O → H2CO3
Een andere methode om koolzuur te synthetiseren is het laten reageren van calciumcarbonaat (CaCO3) met een zuur, zoals zoutzuur (HCl). Dit proces, verzuring genoemd, produceert koolzuur:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Door de reactie tussen oxaalzuur en een carbonaat, zoals natriumcarbonaat (Na2CO3), kan koolzuur worden gesynthetiseerd. Dit proces produceert koolzuur en een zout, zoals natriumoxalaat:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Het Solvay-proces produceert koolzuur en natriumbicarbonaat door de reactie van natriumcarbonaat (Na2CO3) met koolstofdioxide in aanwezigheid van water.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Over het algemeen zijn er verschillende methoden beschikbaar voor de synthese van koolzuur, elk met zijn eigen voordelen en beperkingen. De keuze voor de werkwijze zal afhangen van factoren als de gewenste zuiverheid van het product, de beschikbaarheid van grondstoffen en de benodigde productieschaal.
Gebruik van koolzuur
Koolzuur (H2CO3) is een veelzijdige verbinding die vele toepassingen vindt in de industrie, de geneeskunde en het dagelijks leven. Enkele van de belangrijkste toepassingen van H2CO3 zijn:
- Koolzuurhoudende dranken: H2CO3 is de stof die verantwoordelijk is voor het karakteristieke bruisen in koolzuurhoudende dranken zoals frisdrank en bier.
- H2CO3 buffert de pH in verschillende industriële processen, zoals waterbehandeling en voedselverwerking.
- Het onderdrukt brand door zuurstof te verdringen en verbranding te voorkomen.
- H2CO3 remt de groei van bacteriën en schimmels in bepaalde soorten voedingsproducten om deze te behouden.
- Het werkt als een zacht reinigingsmiddel, vooral om minerale afzettingen te verwijderen.
- Beroepsbeoefenaren in de gezondheidszorg gebruiken H2CO3 in bepaalde toepassingen, onder meer om bepaalde huidlaesies te behandelen en bronchiale vernauwing te veroorzaken tijdens longfunctietests.
- Lassers gebruiken H2CO3 als beschermgas om oxidatie te voorkomen en schonere lassen te produceren.
Over het geheel genomen is koolzuur een nuttige en veelzijdige verbinding met een breed scala aan toepassingen op verschillende gebieden.
Vragen:
Vraag: Is koolzuur een sterk zuur?
A: Koolzuur is een zwak zuur, wat betekent dat het slechts gedeeltelijk dissocieert in water en waterstofionen (H+) en bicarbonaationen (HCO3-) produceert. De zuurdissociatieconstante (Ka) is relatief laag, wat aangeeft dat het niet volledig dissocieert in water.
Vraag: Is kooldioxide zuur?
A: Kooldioxide (CO2) is niet inherent zuur, omdat het een neutrale verbinding is die geen waterstofionen (H+) in water produceert. Wanneer CO2 echter oplost in water, kan het reageren met watermoleculen en koolzuur vormen, wat een zwak zuur is. Deze reactie kan ervoor zorgen dat de pH daalt, waardoor de oplossing zuurder wordt. Hoewel CO2 zelf niet zuur is, kan het dus bijdragen aan de zuurgraad van een oplossing wanneer het reageert met water.
