Benzoëzuur is een kleurloze kristallijne vaste stof die wordt gebruikt als conserveermiddel voor levensmiddelen en als voorloper van vele andere organische verbindingen. Het kan worden gesynthetiseerd uit tolueen of benzeen.
| IUPAC-naam | Benzoëzuur |
| Moleculaire formule | C7H6O2 |
| CAS-nummer | 65-85-0 |
| Synoniemen | Carboxybenzeen, benzeenmierenzuur, fenylmierenzuur, benzeencarbonzuur, E210 |
| InChi | InChI=1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) |
Molaire massa van benzoëzuur
Benzoëzuur heeft een molaire massa van 122,12 g/mol. Het is een eenvoudige organische verbinding die bestaat uit een benzeenring bevestigd aan een functionele carbonzuurgroep. De molaire massa wordt berekend door de atoommassa’s van alle atomen die aanwezig zijn in een enkel molecuul van de verbinding op te tellen. In het geval van benzoëzuur is de formule C7H6O2, dus de molaire massa kan als volgt worden berekend:
7(12,01) + 6(1,01) + 2(16,00) = 122,12 g/mol
Het kennen van de molaire massa is belangrijk voor het bepalen van de hoeveelheid benzoëzuur die nodig is voor chemische reacties en voor het berekenen van andere eigenschappen zoals concentratie en dichtheid.
Structuur van benzoëzuur
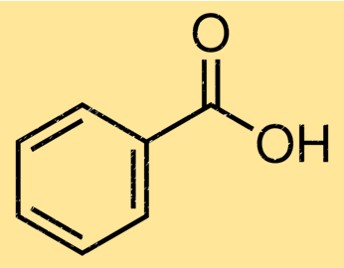
De structuur van benzoëzuur bestaat uit een benzeenring bevestigd aan een functionele carbonzuurgroep. De benzeenring is een zesledige koolstofring met afwisselende dubbele bindingen, terwijl de carbonzuurgroep bestaat uit een koolstofatoom dat dubbel gebonden is aan een zuurstofatoom en een enkele binding aan een hydroxylgroep. De structuur van benzoëzuur is belangrijk bij het bepalen van de chemische en fysische eigenschappen ervan.
Benzoëzuurformule
De chemische formule voor benzoëzuur is C7H6O2. Deze formule vertelt ons dat elk molecuul benzoëzuur zeven koolstofatomen, zes waterstofatomen en twee zuurstofatomen bevat. De formule wordt gebruikt om de molaire massa en het molecuulgewicht van benzoëzuur te bepalen, evenals de verhouding van de elementen die in de verbinding aanwezig zijn.
Smeltpunt van benzoëzuur
Benzoëzuur heeft een smeltpunt van 122,4°C. Dit is de temperatuur waarbij de vaste vorm van benzoëzuur begint te smelten en in een vloeistof verandert. Het smeltpunt wordt beïnvloed door factoren zoals zuiverheid, kristalstructuur en intermoleculaire krachten. Benzoëzuur heeft een relatief hoog smeltpunt vanwege de sterke intermoleculaire krachten, veroorzaakt door waterstofbruggen tussen de carbonzuurgroepen van aangrenzende moleculen.
Kookpunt van BzOH
Het kookpunt van BzOH is 249°C. Dit is de temperatuur waarbij de vloeibare vorm van BzOH begint te verdampen en in een gas verandert. Het kookpunt van een stof wordt beïnvloed door factoren zoals intermoleculaire krachten, druk en de aanwezigheid van onzuiverheden. BzOH heeft een relatief hoog kookpunt vanwege de sterke intermoleculaire krachten, veroorzaakt door waterstofbruggen tussen de carbonzuurgroepen van aangrenzende moleculen.
BzOH-dichtheid g/ml
De dichtheid van BzOH is 1,265 g/ml. Dit is de massa van één milliliter BzOH bij een bepaalde temperatuur en druk. Dichtheid is een belangrijke fysieke eigenschap die wordt gebruikt om de massa van een stof in een bepaald volume te bepalen. De dichtheid van BzOH wordt beïnvloed door factoren zoals temperatuur en druk.
Molecuulgewicht BzOH
Het molecuulgewicht van BzOH is 122,12 g/mol. Dit is de massa van een BzOH-molecuul. Het molecuulgewicht wordt gebruikt om het aantal moleculen in een bepaalde massa van een stof te bepalen. Het wordt berekend door de atoommassa’s van alle atomen in het molecuul op te tellen.
| Verschijning | Witte kristallen |
| Soortelijk gewicht | 1.265 g/cm³ |
| Kleur | Kleurloos |
| Geur | Zwak, aangenaam |
| Molaire massa | 122,12 g/mol |
| Dikte | 1.265 g/cm³ |
| Fusie punt | 250°F |
| Kookpunt | 249°C |
| Flitspunt | 121°C |
| oplosbaarheid in water | 3,8 g/l |
| Oplosbaarheid | Oplosbaar in ethanol, ether, benzeen en chloroform; enigszins oplosbaar in water |
| Dampdruk | 0,00027 mmHg bij 25°C |
| Dampdichtheid | 4,2 (lucht=1) |
| pKa | 4.2 |
| pH | 2,7 – 3,5 |
Veiligheid en gevaren van benzoëzuur
Benzoëzuur (BzOH) kan gevaarlijk zijn als er verkeerd mee wordt omgegaan. Het is irriterend voor de huid en de ogen en kan bij inademing in hoge concentraties irritatie van de luchtwegen veroorzaken. Het innemen van grote hoeveelheden BzOH kan ook misselijkheid, braken en buikpijn veroorzaken. De verbinding is brandbaar en kan ontbranden bij blootstelling aan hitte of vlammen. Het is belangrijk om voorzichtig met BzOH om te gaan, geschikte beschermende uitrusting te dragen en contact met de huid, ogen en slijmvliezen te vermijden. In geval van accidentele blootstelling moeten de getroffen gebieden met water worden afgespoeld en indien nodig medische hulp inroepen. Ook moeten de juiste opslag- en verwijderingsprocedures worden gevolgd om milieuverontreiniging te voorkomen.
| Gevarensymbolen | XI |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen; Draag beschermende handschoenen/bril; Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen; Op een droge plaats bewaren, uit de buurt van hitte en onverenigbare materialen; Houd containers goed gesloten. |
| AN-identificaties | VN 3077 (ADR/RID), VN 1220 (IMDG), VN 3077 (ICAO) |
| HS-code | 2916.31.00 |
| Gevarenklasse | 9 (Diverse gevaarlijke materialen en voorwerpen) |
| Verpakkingsgroep | III |
| Toxiciteit | Benzoëzuur is relatief niet-toxisch, met een orale LD50 bij ratten van 1700 tot 1940 mg/kg. Het kan bij inademing in hoge concentraties huid- en oogirritatie en irritatie van de luchtwegen veroorzaken. Inname van grote hoeveelheden kan ook maag-darmklachten veroorzaken. |
Methoden voor de synthese van benzoëzuur
Benzoëzuur (BzOH) kan op verschillende manieren worden gesynthetiseerd.
Een gebruikelijke methode is het oxideren van tolueen of benzylchloride met behulp van kaliumpermanganaat of chroomzuur. Een andere methode omvat het laten reageren van benzeen met kooldioxide en een metaalkatalysator, zoals koper- of magnesiumoxide, in aanwezigheid van hitte en druk.
BzOH kan worden verkregen door hydrolyse van benzamide, benzoylchloride of benzotrifluoride met behulp van een sterke base, zoals natriumhydroxide. Dit proces levert BzOH en het overeenkomstige amine of alcohol op. Als alternatief kan BzOH worden verkregen door benzylalcohol te laten reageren met kaliumpermanganaat of natriumdichromaat.
Een Grignard-reagens, gevormd door magnesium en een alkyl- of arylhalogenide te laten reageren met koolstofdioxide, kan worden gebruikt om BzOH te synthetiseren. Om het resulterende carbonzuur in BzOH om te zetten, kan de oplossing worden aangezuurd.
BzOH kan worden geproduceerd door tolueen te oxideren in aanwezigheid van een kobalt- of mangaankatalysator. Deze methode is vooral nuttig voor productie op grote schaal.
Elk van deze synthesemethoden heeft voor- en nadelen, afhankelijk van de specifieke toepassing en productieschaal. Het is belangrijk om de meest geschikte methode te kiezen op basis van factoren zoals kosten, effectiviteit en impact op het milieu.
Gebruik van benzoëzuur
- Mensen gebruiken benzoëzuur (BzOH) vaak als voedselconserveermiddel omdat het de groei van bacteriën en schimmels kan remmen.
- Fabrikanten gebruiken het als tussenproduct bij de synthese van verschillende chemicaliën, waaronder kleurstoffen, parfums en farmaceutische producten.
- Producenten gebruiken BZOH bij de vervaardiging van weekmakers, zoals benzylbenzoaat, die worden gebruikt bij de productie van PVC en andere kunststoffen.
- Het speelt een essentiële rol bij de productie van fenol, dat wordt gebruikt bij de vervaardiging van harsen, lijmen en ontsmettingsmiddelen.
- Fabrikanten voegen BZOH toe aan huisdiervoer om de groei van schimmels en bacteriën te voorkomen.
- Het fungeert als een voorloper van benzoylperoxide, dat wordt gebruikt bij de behandeling van acne.
- Producenten gebruiken BZOH bij de productie van verschillende soorten polymeren, waaronder polyester, nylon en polyurethaan.
- Industrieën gebruiken het als oplosmiddel voor verschillende organische verbindingen, waaronder harsen, oliën en wassen.
- Fabrikanten gebruiken BZOH bij de productie van verschillende soorten zouten, zoals natriumbenzoaat, die worden gebruikt als voedselconserveermiddel en antimicrobiële middelen.
- BZOH wordt gebruikt bij de productie van diverse soorten wasmiddelen, waaronder wasmiddelen, afwasmiddelen en schoonmaakmiddelen.
Vragen:
Vraag: Is benzoëzuur oplosbaar in water?
A: BzOH is slecht oplosbaar in water, met een oplosbaarheid van 3,4 g/L bij 25°C. Het is echter beter oplosbaar in organische oplosmiddelen zoals ethanol en aceton.
Vraag: Is benzoëzuur een sterk zuur?
A: Nee, BzOH is een zwak zuur. In water dissocieert het gedeeltelijk om hydroniumionen en benzoaationen te vormen. De dissociatieconstante (Ka) is 6,5 x 10^-5, wat wijst op de zwakzure aard ervan.
Vraag: Een oplossing van 0,20 M benzoëzuur (C6H5COOH) heeft een pH van 2,45. Wat is Ka voor benzoëzuur?
A: De Ka van BzOH kan worden berekend met behulp van de pH van de oplossing en de concentratie van het zuur. Met behulp van de pH van 2,45 en de BzOH-dissociatievergelijking wordt de Ka berekend als 6,5 x 10^-5.
Vraag: Is benzoëzuur polair of niet-polair?
A: Benzoëzuur is een polair molecuul vanwege de aanwezigheid van de functionele carbonzuurgroep, die een elektronegatief zuurstofatoom bevat dat een dipoolmoment creëert.
