Ammoniumchloride of NH4Cl is een wit kristallijn zout dat in verschillende toepassingen wordt gebruikt, waaronder medicijnen en kunstmest. Het wordt gevormd door de reactie van ammoniak en zoutzuur en heeft een uitgesproken zoute smaak.
| IUPAC-naam | Ammoniumchloride |
| Moleculaire formule | NH4Cl |
| CAS-nummer | 12125-02-9 |
| Synoniemen | Sal ammoniak, Salmiak, Nushadir zout, Amchloor, Sal armagnac, Hydrochloraat, Ammoniummuriaat, Sal armagnac |
| InChi | InChI=1S/ClH.H3N/h1H;1H3 |
NH4Cl molaire massa
Ammoniumchloride heeft een molaire massa van 53,49 g/mol. Molaire massa verwijst naar de massa van één mol van een stof en wordt uitgedrukt in gram per mol (g/mol). De molmassa van ammoniumchloride wordt bepaald door de atoommassa’s van de samenstellende atomen, namelijk stikstof (N), waterstof (H) en chloor (Cl), op te tellen. De molecuulformule voor ammoniumchloride is NH4Cl, wat betekent dat het één stikstofatoom, vier waterstofatomen en één chlooratoom bevat. Daarom kan de molmassa van ammoniumchloride als volgt worden berekend
Molaire massa = (1 x atoommassa van N) + (4 x atoommassa van H) + (1 x atoommassa van Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/mol
Kookpunt van ammoniumchloride
Het kookpunt van ammoniumchloride is 520°C (968°F). Het kookpunt is de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan de externe druk die erop wordt uitgeoefend. Bij deze temperatuur verdampt ammoniumchloride en gaat het over in een gasvormige toestand. Het hoge kookpunt van ammoniumchloride is te danken aan de sterke ionische bindingen tussen ammonium- (NH4+) en chloride- (Cl-) ionen.
Smeltpunt van ammoniumchloride
Het smeltpunt van ammoniumchloride is 338°C (640°F). Het smeltpunt is de temperatuur waarbij een vaste stof in een vloeistof verandert. Bij deze temperatuur worden de ionische bindingen tussen de ammonium- (NH4+) en chloride- (Cl-) ionen verbroken en verandert het ammoniumchloride van een vaste stof in een vloeistof. Ammoniumchloride heeft een relatief laag smeltpunt vergeleken met andere ionische verbindingen, waardoor het bruikbaar is in bepaalde toepassingen zoals lassen en metallurgie.
Dichtheid van ammoniumchloride g/ml
De dichtheid van ammoniumchloride is 1,527 g/cm³. Dichtheid is een maatstaf voor de hoeveelheid massa per volume-eenheid van een stof. De hoge dichtheid van ammoniumchloride is te danken aan de zeer compacte ionische roosterstructuur. Ammoniumchloride heeft een hogere dichtheid dan water, waardoor het in water zal zinken.
Molecuulgewicht van ammoniumchloride
Het molecuulgewicht van ammoniumchloride is 53,49 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. Het molecuulgewicht van ammoniumchloride is hetzelfde als de molaire massa.
Structuur van ammoniumchloride
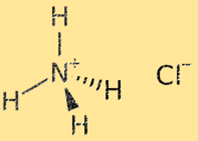
De structuur van ammoniumchloride is een kristalrooster dat bestaat uit afwisselende ammonium- (NH4+) en chloride- (Cl-) ionen. Het ammoniumion is een polyatomair ion met een positieve lading (+1), bestaande uit één stikstofatoom en vier waterstofatomen. Het chloride-ion is een monoatomair ion met een negatieve lading (-1), bestaande uit een chlooratoom. De kristalroosterstructuur van ammoniumchloride wordt gestabiliseerd door sterke ionische bindingen tussen ammonium- en chloride-ionen, wat resulteert in een zeer stabiele en brosse vaste stof.
Ammoniumchloride-formule
De formule voor ammoniumchloride is NH4Cl. Het bestaat uit een ammoniumion (NH4+) en een chloride-ion (Cl-). De formule geeft de verhouding van de atomen in een molecuul weer en laat zien dat er voor elk ammoniumion één chloride-ion is. De ammoniumchlorideformule wordt gebruikt om de molaire massa, dichtheid en andere eigenschappen van de verbinding te bepalen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 1.527 g/cm³ |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 53,49 g/mol |
| Dikte | 1.527 g/cm³ |
| Fusie punt | 338°C (640°F) |
| Kookpunt | 520°C (968°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 29,7 g/100 ml (25°C) |
| Oplosbaarheid | Oplosbaar in ethanol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | 9:25 uur |
| pH | 4,6 (5% oplossing) |
Veiligheid en gevaren van ammoniumchloride
Ammoniumchloride (NH4Cl) wordt over het algemeen als veilig beschouwd voor normaal gebruik. Het kan echter schadelijk zijn als het in grote hoeveelheden wordt ingenomen of ingeademd. Inslikken van NH4Cl kan mond- en keelirritatie, misselijkheid, braken en diarree veroorzaken. Inademing van NH4Cl kan irritatie van de luchtwegen, hoesten en kortademigheid veroorzaken. Met NH4Cl moet voorzichtig worden omgegaan, omdat het huid- en oogirritatie kan veroorzaken. Het is ook belangrijk om blootstelling aan NH4Cl-stof of -damp te vermijden, die irriterend kan zijn voor de ogen, neus en keel. Bij het hanteren van NH4Cl moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen.
| Gevarensymbolen | XI |
| Beveiligingsbeschrijving | S22, S24/25, S36/37/39 |
| VN-identificatienummers | VN 3077 |
| HS-code | 2827.10.00 |
| Gevarenklasse | 9 – Diverse gevaarlijke goederen |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit, maar kan schadelijk zijn bij inslikken of inademen van grote hoeveelheden. |
Methoden voor de synthese van ammoniumchloride
Ammoniumchloride (NH4Cl) kan op verschillende manieren worden gesynthetiseerd.
- Een gebruikelijke methode is om ammoniakgas te laten reageren met zoutzuur in water. Deze exotherme reactie produceert NH4Cl in de vorm van een witte kristallijne vaste stof. Het is belangrijk om het zoutzuur langzaam en al roerend aan het water toe te voegen om spatten door de gegenereerde hitte te voorkomen.
- Een andere methode om NH4Cl te produceren is als bijproduct van verschillende industriële processen, zoals de productie van natriumcarbonaat of het Solvay-proces.
- Een andere manier om NH4Cl te synthetiseren is door ammoniak te laten reageren met natriumchloride. Deze reactie produceert zowel NH4Cl als natriumhydroxide. Deze reactie is exotherm en vereist zorgvuldige controle om de vorming van ongewenste bijproducten te voorkomen.
Gebruik van ammoniumchloride
Ammoniumchloride (NH4Cl) heeft vele toepassingen in verschillende industrieën.
- NH4Cl dient als meststof in de landbouw en levert essentiële voedingsstoffen aan gewassen zoals stikstof en chloride, waardoor de opbrengst en kwaliteit worden verbeterd.
- Ammoniumchloride vergemakkelijkt de goede werking van droge cellen door elektriciteit als elektrolyt te geleiden.
- De textielindustrie gebruikt NH4Cl als verf- en drukmiddel, dat helpt kleurstoffen op stoffen te fixeren en de kleurechtheid te verbeteren.
- Als vloeimiddel bij metaalbewerking en solderen verwijdert NH4Cl oxidelagen van metalen, waardoor lassen gemakkelijker wordt.
- De chemische stof heeft toepassingen in voedingsmiddelen, farmaceutische producten en cosmetica als smaakstof, slijmoplossend middel in hoestmedicijnen en als ingrediënt in producten voor persoonlijke verzorging.
Over het geheel genomen maken de unieke eigenschappen van NH4Cl het tot een veelzijdige chemische stof met veel belangrijke toepassingen in verschillende industrieën.
Vragen:
Vraag: Is ammoniumchloride subliem?
A: Ja, het is bekend dat ammoniumchloride sublimeert, wat betekent dat het rechtstreeks van een vaste fase naar een gasfase kan gaan zonder daartussen te smelten.
Vraag: Is NH4Cl zuur of basisch?
A: Ammoniumchloride is een zuur zout. Wanneer het in water wordt opgelost, kan het hydrolyse ondergaan om een zure oplossing te produceren. Dit komt omdat het ammoniumion als een zwak zuur werkt en een proton (H+) aan watermoleculen doneert.
Vraag: Wat is de formule voor ammoniumchloride?
A: De formule voor ammoniumchloride is NH4Cl. Het bestaat uit een ammoniumion (NH4+) en een chloride-ion (Cl-), bij elkaar gehouden door ionische bindingen.
Vraag: Lost ammoniumchloride op in water?
A: Ja, ammoniumchloride is zeer oplosbaar in water. Bij kamertemperatuur kan ongeveer 29,7 gram ammoniumchloride oplossen in 100 milliliter water.
Vraag: Hoe ammoniumchloride en natriumchloride scheiden?
A: Eén manier om ammoniumchloride en natriumchloride te scheiden is sublimatie. Dit kan worden bereikt door het mengsel te verwarmen, waardoor het ammoniumchloride sublimeert terwijl het natriumchloride in vaste vorm blijft. Het gesublimeerde ammoniumchloride kan vervolgens worden verzameld en opnieuw worden gecondenseerd tot een vaste vorm. Een andere methode is om het mengsel in water op te lossen en vervolgens een van de zouten selectief neer te slaan met behulp van een specifiek reagens of pH-aanpassing.
