Neopentaan is een sterk vertakte koolwaterstof met vier methylgroepen gebonden aan een centraal koolstofatoom. Het wordt vaak gebruikt als referentieverbinding bij NMR-spectroscopie en als brandstofadditief.
| IUPAC-naam | 2,2-dimethylpropaan |
| Moleculaire formule | C5H12 |
| CAS-nummer | 463-82-1 |
| Synoniemen | Dimethylpropaan, tetramethylmethaan, 2,2-dimethylpropaan, Neo-C5H12, UN 2043 |
| InChi | InChI=1S/C5H12/c1-5(2,3)4/h1-4H3 |
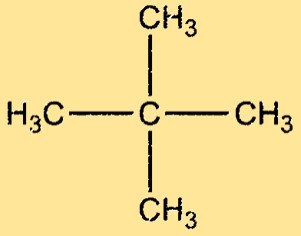
Neopentaan structuur
Neopentaan heeft een sterk vertakte structuur, met vier methylgroepen bevestigd aan een centraal koolstofatoom. Het molecuul is symmetrisch en tetraëdrisch, met een bindingshoek van 109,5° tussen elk paar aangrenzende koolstofatomen. Het neopentaanmolecuul is niet-polair, met slechts zwakke Van der Waals-krachten tussen de moleculen.
Kookpunt van neopentaan
Het kookpunt van neopentaan is -9,5°C (-15°F) bij standaarddruk. Dit lage kookpunt is te wijten aan de zwakke intermoleculaire krachten tussen de moleculen, waardoor het relatief gemakkelijk te verdampen is. Neopentaan is bij kamertemperatuur en druk een kleurloos gas en wordt vaak gebruikt als referentieverbinding voor gaschromatografie.
Neopentaan molaire massa
Neopentaan, ook bekend als 2,2-dimethylpropaan, heeft een molaire massa van 72,15 g/mol. Het is een sterk vertakte koolwaterstof met vier methylgroepen gebonden aan een centraal koolstofatoom. De molaire massa van neopentaan kan worden berekend door de atoomgewichten van alle atomen in de molecuulformule, die C5H12 is, bij elkaar op te tellen.
Neopentaan Smeltpunt
Het smeltpunt van neopentaan is -16,6°C (2°F) bij standaarddruk. Net als het kookpunt is het lage smeltpunt van neopentaan het gevolg van zijn zwakke intermoleculaire krachten. Neopentaan is een niet-polair molecuul met slechts zwakke Van der Waals-krachten tussen de moleculen, waardoor het geen sterke kristalstructuren vormt.
Neopentaan Dichtheid g/ml
De dichtheid van neopentaan is 0,623 g/ml bij standaardtemperatuur en -druk. Deze lage dichtheid is te wijten aan het lage molecuulgewicht van neopentaan, namelijk slechts 72,15 g/mol. Neopentaan heeft een lagere dichtheid dan water, dus het zal op het wateroppervlak drijven als de twee worden gemengd.
Moleculair gewicht van neopentaan
Het molecuulgewicht van tetramethylmethaan is 72,15 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen van het molecuul, bestaande uit vijf koolstofatomen en 12 waterstofatomen. Het lage molecuulgewicht van tetramethylmethaan maakt het een zeer vluchtige en brandbare verbinding.
Tetramethylmethaan-formule
De molecuulformule voor tetramethylmethaan is C5H12, wat het aantal en de soorten atomen weergeeft die in het molecuul aanwezig zijn. De formule geeft aan dat er vijf koolstofatomen en twaalf waterstofatomen in het tetramethylmethaanmolecuul zitten. De molecuulformule geeft geen informatie over de rangschikking van atomen binnen het molecuul, die wordt bepaald door de structuur ervan.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,623 g/ml bij 20°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 72,15 g/mol |
| Dikte | 0,623 g/ml bij 20°C |
| Fusie punt | -16,6°C |
| Kookpunt | -9,5°C |
| Flitspunt | -49°C |
| oplosbaarheid in water | 0,04 g/l bij 20°C |
| Oplosbaarheid | Onoplosbaar in water |
| Dampdruk | 566 mmHg bij 20°C |
| Dampdichtheid | 2,5 (lucht = 1) |
| pKa | ~50 |
| pH | Niet toepasbaar |
Veiligheid en gevaren van neopentaan
Tetramethylmethaan is een licht ontvlambaar gas en kan met lucht explosieve mengsels vormen. Het kan ook bevriezing veroorzaken als het in contact komt met de huid, omdat het kookpunt zeer laag is, namelijk -9,5°C. Het inademen van tetramethylmethaangas kan duizeligheid, misselijkheid en hoofdpijn veroorzaken. Het is belangrijk om voorzichtig om te gaan met tetramethylmethaan en blootstelling aan vlammen, vonken of andere ontstekingsbronnen te vermijden. Tetramethylmethaan moet worden bewaard op een koele, droge en goed geventileerde plaats, beschermd tegen hitte en oxidatiemiddelen. Bij het hanteren van tetramethylmethaan moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen.
| Gevarensymbolen | F+ |
| Beveiligingsbeschrijving | Licht ontvlambaar gas. Kan bevriezing veroorzaken. Alleen in een goed geventileerde ruimte gebruiken. Verwijderd houden van hitte en ontstekingsbronnen. Draag beschermende handschoenen en een bril. |
| EEN ID | VN2451 |
| HS-code | 2901.1 |
| Gevarenklasse | 2.1 |
| Verpakkingsgroep | Geen |
| Toxiciteit | Lage toxiciteit |
Methoden voor synthese van neopentaan
Er zijn verschillende methoden voor het synthetiseren van tetramethylmethaan.
Een gebruikelijke methode omvat de reactie van isobuteen en formaldehyde via een vaste zure katalysator, zoals zeoliet. De reactie produceert neopentylalcohol, die vervolgens kan worden gedehydrateerd om tetramethylmethaan op te leveren.
Een andere methode voor het synthetiseren van tetramethylmethaan omvat de thermische ontleding van 2,2-dimethylpropaan bij hoge temperaturen. Deze reactie produceert tetramethylmethaan en andere koolwaterstoffen.
Een derde methode omvat de reactie van ethylchloride en zink in aanwezigheid van magnesium om diethylzink te produceren, dat vervolgens kan reageren met isobuteen om tetramethylmethaan te produceren.
Tetramethylmethaan kan worden gesynthetiseerd door isopenteen te hydrogeneren, dat het resultaat is van de dehydrogenering van isopentaan.
Afhankelijk van verschillende factoren zoals beschikbaarheid van grondstoffen, kosten, gewenste opbrengst en zuiverheid van het eindproduct, kunnen verschillende methoden voor de tetramethylmethaansynthese worden aangepast.
Gebruik van neopentaan
Tetramethylmethaan heeft verschillende belangrijke industriële en wetenschappelijke toepassingen.
- Het wordt gebruikt als referentiemateriaal voor gaschromatografie, dankzij de hoge zuiverheid en goed gedefinieerde eigenschappen.
- Tetramethylmethaan wordt ook gebruikt als standaard voor calorimetrische en thermodynamische metingen.
- Een ander belangrijk gebruik van tetramethylmethaan is als blaasmiddel bij de productie van polyurethaanschuim, dat in een breed scala aan toepassingen wordt gebruikt, zoals isolatie, demping en verpakking.
- Het wordt gebruikt als koelmiddel in koelsystemen vanwege het lage kookpunt en de goede thermodynamische eigenschappen. Het gebruik ervan als koelmiddel is echter grotendeels stopgezet vanwege de hoge ontvlambaarheid en de potentiële gevolgen voor het milieu.
- Tetramethylmethaan wordt ook gebruikt bij de synthese van andere organische verbindingen, zoals neopentylglycol, dat wordt gebruikt bij de productie van harsen, coatings en kunststoffen.
De unieke eigenschappen maken het tot een veelzijdige en waardevolle verbinding voor diverse industriële en wetenschappelijke toepassingen. De potentiële gevaren van tetramethylmethaan moeten echter zorgvuldig worden overwogen en beheerd om een veilig en verantwoord gebruik te garanderen.
Vragen:
Vraag: Hoeveel chirale koolstofatomen heeft neopentaan (2,2-dimethylpropaan)?
A: Neopentaan heeft geen chirale koolstofatomen. Het is een symmetrisch molecuul met tetraëdrische geometrie rond elk koolstofatoom, dus alle koolstofatomen zijn gelijkwaardig.
Vraag: Welke heeft het hogere kookpunt: hexaan, pentaan of neopentaan?
A: Hexaan heeft het hoogste kookpunt, gevolgd door pentaan en vervolgens neopentaan. Het kookpunt van een koolwaterstof neemt inderdaad toe met zijn molecuulgewicht en zijn specifieke oppervlak, evenals met de sterkte van zijn intermoleculaire krachten. Hexaan heeft het hoogste molecuulgewicht en specifieke oppervlak van de drie verbindingen en heeft ook de sterkste intermoleculaire krachten vanwege de lineaire structuur, wat leidt tot een hoger kookpunt. Pentaan en neopentaan hebben lagere kookpunten vanwege hun kleinere moleculaire omvang en zwakkere intermoleculaire krachten.
