Dichloormethaan (CH2Cl2) of methyleenchloride lost een breed scala aan organische verbindingen op en wordt vaak gebruikt als oplosmiddel in chemische laboratoria. Het kan ook worden gebruikt bij het afbijten en ontvetten van verf.
| IUPAC-naam | Dichloormethaan |
| Moleculaire formule | CH2Cl2 |
| CAS-nummer | 75-09-2 |
| Synoniemen | Methyleenchloride, methyleendichloride, DCM, Narkotil, Solaesthin, Solmethine, enz. |
| InChi | InChI=1S/CH2Cl2/c2-1-3/h1H2 |
Dichloormethaan Dichtheid g/ml
De dichtheid van dichloormethaan is 1,326 g/ml. Deze waarde geeft de massa dichloormethaan per volume-eenheid aan bij een gegeven temperatuur en druk. De dichtheid van dichloormethaan is relatief hoog, waardoor het een dichtere vloeistof is dan water. Deze eigenschap maakt het nuttig in sommige laboratoriumtoepassingen, waar het kan worden gebruikt om stoffen met verschillende dichtheden te scheiden.
Kookpunt van dichloormethaan
Het kookpunt van dichloormethaan is 39,6°C (103,3°F). Deze temperatuur geeft het punt aan waarop de vloeibare vorm van dichloormethaan zal veranderen in zijn gasvormige toestand. Het lage kookpunt van dichloormethaan maakt het een zeer vluchtige verbinding die gemakkelijk kan verdampen bij kamertemperatuur. Deze eigenschap maakt het bruikbaar als oplosmiddel in veel laboratoriumtoepassingen, waar het gemakkelijk kan worden verdampt.
Molaire massa van dichloormethaan
De molaire massa van dichloormethaan, ook wel methyleenchloride genoemd, is 84,93 g/mol. Deze waarde wordt verkregen door de atoommassa’s van de atomen van één enkel molecuul dichloormethaan op te tellen. De molecuulformule voor dichloormethaan is CH2Cl2, wat aangeeft dat het één koolstofatoom, twee waterstofatomen en twee chlooratomen bevat. Molaire massa is een belangrijke eigenschap voor het bepalen van de hoeveelheid van een stof die in een bepaald monster aanwezig is.
Smeltpunt van dichloormethaan
Het smeltpunt van CH2Cl2 is -97,4°C (-143,3°F). Deze temperatuur geeft het punt aan waarop de vaste vorm van CH2Cl2 overgaat in de vloeibare toestand. CH2Cl2 wordt echter zelden in vaste vorm aangetroffen, omdat het bij kamertemperatuur een vluchtige vloeistof is. Het lage smeltpunt van CH2Cl2 maakt het moeilijk om te bevriezen en het blijft zelfs bij lage temperaturen vloeibaar.
Dichloormethaan Moleculair gewicht
Het molecuulgewicht van CH2Cl2 bedraagt 84,93 g/mol. Deze waarde is de som van de atoomgewichten van de atomen van een enkel CH2Cl2-molecuul. Het molecuulgewicht is een belangrijke eigenschap voor het bepalen van de hoeveelheid van een stof die in een bepaald monster aanwezig is.
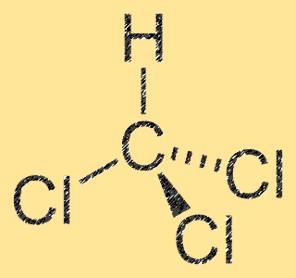
Structuur van dichloormethaan
CH2Cl2 heeft een tetraëdrische moleculaire structuur, met een centraal koolstofatoom gebonden aan twee chlooratomen en twee waterstofatomen. Het molecuul heeft een dipoolmoment, dat het gevolg is van het verschil in elektronegativiteit tussen de koolstof- en chlooratomen. Het koolstofatoom heeft een gedeeltelijk positieve lading, terwijl de chlooratomen een gedeeltelijk negatieve lading hebben. Deze eigenschap maakt CH2Cl2 een polair molecuul.
Dichloormethaan-formule
De molecuulformule voor dichloormethaan is CH2Cl2. De formule geeft aan dat het molecuul één koolstofatoom, twee waterstofatomen en twee chlooratomen bevat. De formule geeft ook informatie over het relatieve aantal atomen in een enkel dichloormethaanmolecuul. De formule is nuttig voor het bepalen van de stoichiometrie van chemische reacties waarbij dichloormethaan betrokken is.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.326 |
| Kleur | Kleurloos |
| Geur | Milde geur, vergelijkbaar met chloroform |
| Molaire massa | 84,93 g/mol |
| Dikte | 1.326 g/ml |
| Fusie punt | -97,4°C (-143,3°F) |
| Kookpunt | 39,6°C (103,3°F) |
| Flitspunt | -22°C (-8°F) |
| oplosbaarheid in water | 16,5 g/l bij 20°C (68°F) |
| Oplosbaarheid | Mengbaar met veel organische oplosmiddelen |
| Dampdruk | 44,6 kPa bij 20°C (68°F) |
| Dampdichtheid | 2,93 |
| pKa | 4 |
| pH | Neutrale |
Veiligheid en gevaren van dichloormethaan
Dichloormethaan (CH2Cl2), ook bekend als methyleenchloride, is een gevaarlijke chemische stof die aanzienlijke veiligheidsrisico’s met zich meebrengt als deze niet op de juiste manier wordt behandeld. Het is licht ontvlambaar en kan brand of explosies veroorzaken als het wordt blootgesteld aan hitte of open vuur. Het inademen van de dampen kan irritatie van de luchtwegen, hoofdpijn, duizeligheid en zelfs bewustzijnsverlies veroorzaken. Huidcontact met CH2Cl2 kan irritatie, brandwonden of chemische brandwonden veroorzaken. Het is ook een potentieel carcinogeen, waarbij langdurige blootstelling het risico op lever- en longkanker verhoogt. Goede veiligheidsmaatregelen, zoals het gebruik van geschikte persoonlijke beschermingsmiddelen en het werken in een goed geventileerde ruimte, zijn essentieel bij het werken met CH2Cl2.
| Gevarensymbolen | Xn, F |
| Beveiligingsbeschrijving | Licht ontvlambare vloeistof en damp. Schadelijk bij inslikken, inademen of opname via de huid. Veroorzaakt huidirritatie en ernstige oogirritatie. Kan irritatie van de luchtwegen veroorzaken. Kan slaperigheid of duizeligheid veroorzaken. Kan dodelijk zijn als het bij inslikken in de luchtwegen terechtkomt. |
| AN-identificaties | VN 1593 |
| HS-code | 29031200 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Dichloormethaan is geclassificeerd als kankerverwekkend uit categorie 2 en is in verband gebracht met lever- en longkanker. Het is ook bekend dat het depressie van het centrale zenuwstelsel veroorzaakt en dodelijk kan zijn als het in hoge concentraties wordt ingenomen of ingeademd. Bij het werken met dichloormethaan moeten altijd de juiste veiligheidsmaatregelen worden genomen. |
Synthesemethoden voor dichloormethaan
Er zijn verschillende methoden voor het synthetiseren van dichloormethaan (CH2Cl2), een kleurloze vloeistof die wordt gebruikt als oplosmiddel en verfafbijtmiddel. Een gebruikelijke methode omvat de reactie van methaangas met chloorgas in aanwezigheid van een katalysator, meestal aluminiumchloride of ijzerchloride. De reactie produceert zowel CH2Cl2 als waterstofchloridegas als bijproducten. Een andere methode omvat de chlorering van methanol met waterstofchloridegas of thionylchloride. Deze reactie produceert ook CH2Cl2 als product, evenals water of zwaveldioxide als bijproducten.
Een andere methode omvat de reactie van chloroform met zink in aanwezigheid van zoutzuur. Deze reactie produceert zowel CH2Cl2 als zinkchloride als producten, met waterstofgas als bijproduct.
Chlorering van verschillende organische verbindingen, zoals ethaan of propaan, in aanwezigheid van een katalysator kan CH2Cl2 als bijproduct opleveren.
Ongeacht de gebruikte methode is het belangrijk om voorzichtig om te gaan met CH2Cl2 vanwege de gevaarlijke eigenschappen ervan. Bij het synthetiseren en hanteren van CH2Cl2 is het belangrijk om passende veiligheidsmaatregelen te nemen, zoals het dragen van geschikte persoonlijke beschermingsmiddelen en het werken in een goed geventileerde ruimte.
Gebruik van dichloormethaan
Dichloormethaan, ook bekend als methyleenchloride, vindt vele toepassingen in de industrie en onderzoek als een veelzijdig organisch oplosmiddel. Het speelt een cruciale rol bij de productie van farmaceutische producten en coatings zoals verven en vernissen. Bovendien is het een nuttig reinigingsmiddel in de elektronica- en metallurgische industrie voor ontvetting.
Dichloormethaan lost en verwijdert vele soorten verf en coatings, waardoor het een populair afbijtmiddel is. Ook opmerkelijk is het gebruik ervan als blaasmiddel bij de productie van polyurethaanschuimen, polycarbonaatharsen en andere kunststoffen.
Naast zijn industriële toepassingen is dichloormethaan waardevol bij de extractie van natuurlijke producten zoals essentiële oliën en parfums uit plantaardig materiaal. Het is ook een effectief oplosmiddel voor veel organische verbindingen die worden gebruikt in laboratoriumreagentia bij organische synthese.
Dichloormethaan vereist echter zorgvuldige omgang vanwege de gevaarlijke eigenschappen ervan, zoals ontvlambaarheid en toxiciteit. Het is belangrijk om de juiste veiligheidsmaatregelen te nemen, waaronder werken in een goed geventileerde ruimte en het dragen van geschikte persoonlijke beschermingsmiddelen bij het werken met dichloormethaan.
Vragen:
Vraag: Is dichloormethaan polair?
A: Ja, dichloormethaan is een polair oplosmiddel.
Vraag: Welke van de volgende risico’s houden verband met dichloormethaan?
A: Gevaren die verband houden met dichloormethaan zijn onder meer de ontvlambaarheid, toxiciteit en de kans op irritatie van de huid en de luchtwegen.
Vraag: Is dichloormethaan brandbaar?
A: Ja, dichloormethaan is brandbaar en kan brand of explosies veroorzaken als het wordt blootgesteld aan hitte of open vuur.
Vraag: Is dichloormethaan oplosbaar in water?
A: Ja, dichloormethaan is enigszins oplosbaar in water. Het wordt echter voornamelijk gebruikt als oplosmiddel voor niet-polaire verbindingen en wordt niet vaak gebruikt in waterige oplossingen.
