Chloorheptoxide of Cl2O7 is een zeer explosieve en reactieve verbinding. Het kan heftig ontleden bij contact met organisch materiaal en is een krachtig oxidatiemiddel dat wordt gebruikt bij chemische synthese en analyse.
| IUPAC-naam | Chloorheptoxide |
| Moleculaire formule | Cl2O7 |
| CAS-nummer | 12015-53-1 |
| Synoniemen | Perchlooranhydride, dichloorheptoxide, chloor (VII) oxide, chlooroxide, perchlorylperchloraat |
| InChi | InChI=1S/Cl2O7/c2-1(3,4,5,6)10-7(8,9)11-12-13-14-10 |
Molaire massa chloorheptoxide
Chloorheptoxide, chemische formule Cl2O7, heeft een molaire massa van 182,9 g/mol. Deze verbinding bestaat uit twee chlooratomen en zeven zuurstofatomen, waardoor het een sterk oxidatiemiddel is. De molaire massa van chloorheptoxide wordt gebruikt om de hoeveelheid stof in een bepaalde massa of volume van een monster te berekenen met behulp van de constante van Avogadro.
Kookpunt van chloorheptoxide
Chloorheptoxide is een kleurloze tot geelachtige, zeer reactieve en vluchtige vaste stof. Het kookpunt van chloorheptoxide is niet goed gedefinieerd, aangezien het ontleedt voordat het zijn kookpunt bereikt. Chloorheptoxide is een krachtig oxidatiemiddel dat kan reageren met organisch materiaal, water en andere stoffen om explosieve verbindingen te vormen.
Smeltpunt van chloorheptoxide
Chloorheptoxide heeft een smeltpunt van -96°C (-141°F), waardoor het een laagsmeltende vaste stof is. Chloorheptoxide kan bij kamertemperatuur als een geelachtige vloeistof voorkomen vanwege het lage smeltpunt en de hoge reactiviteit. Het is belangrijk om voorzichtig om te gaan met chloorheptoxide, omdat dit ernstige brandwonden kan veroorzaken en een sterk oxidatiemiddel is.
Dichtheid van chloorheptoxide g/ml
De dichtheid van chloorheptoxide is 2,48 g/ml bij kamertemperatuur. De hoge dichtheid van chloorheptoxide maakt het een dichte vloeistof die snel naar de bodem van een container kan zinken. De hoge dichtheid en reactiviteit van chloorheptoxide maken het een moeilijk te hanteren verbinding en vereist speciale veiligheidsmaatregelen bij gebruik bij chemische synthese of analyse.
Molecuulgewicht van chloorheptoxide
Het molecuulgewicht van chloorheptoxide, ook bekend als relatieve molecuulmassa, is 182,9 g/mol. Het molecuulgewicht van chloorheptoxide is belangrijk bij chemische berekeningen met betrekking tot de hoeveelheid stof, massa en volume. Het hoge molecuulgewicht van chloorheptoxide maakt het tot een dichte, vluchtige verbinding die zorgvuldige behandeling en opslag vereist.
Structuur van chloorheptoxide
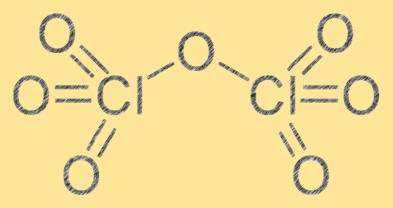
De structuur van chloorheptoxide bestaat uit twee chlooratomen en zeven zuurstofatomen. Het heeft de molecuulformule Cl2O7 en de moleculaire geometrie ervan is een vervormde octaëdrische vorm als gevolg van afstoting tussen zuurstofatomen. Chloorheptoxide is een sterk oxidatiemiddel en kan reageren met verschillende organische en anorganische stoffen. De structuur van chloorheptoxide is essentieel voor het begrijpen van de chemische eigenschappen en het gedrag ervan in verschillende reacties.
Formule voor chloorheptoxide
De chemische formule voor chloorheptoxide is Cl2O7. De formule geeft aan dat elk molecuul chloorheptoxide twee chlooratomen en zeven zuurstofatomen bevat. De formule wordt gebruikt om de stoichiometrie van chemische reacties waarbij chloorheptoxide betrokken is, te berekenen. De formule van chloorheptoxide is ook belangrijk bij het bepalen van het molecuulgewicht, de dichtheid en andere fysische en chemische eigenschappen.
| Verschijning | Kleurloze tot geelachtige vaste stof |
| Soortelijk gewicht | 2,48 bij 25°C |
| Kleur | Kleurloos tot geelachtig |
| Geur | Kruidig, zuur |
| Molaire massa | 182,9 g/mol |
| Dikte | 2,48 g/ml bij 25°C |
| Fusie punt | -96°C (-141°F) |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert hevig met water |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van chloorheptoxide
Chloorheptoxide is een zeer reactieve en gevaarlijke verbinding die aanzienlijke veiligheidsrisico’s met zich meebrengt als deze niet op de juiste manier wordt behandeld. Het kan bij contact ernstige brandwonden en schade aan de ogen, huid en luchtwegen veroorzaken. Chloorheptoxide kan ook heftig reageren met water en organische materialen, waardoor explosies en brandgevaar ontstaan. Het is essentieel om geschikte persoonlijke beschermingsmiddelen te gebruiken, waaronder handschoenen, een veiligheidsbril en een ademhalingstoestel, wanneer u met chloorheptoxide werkt. Het mengsel moet worden opgeslagen en vervoerd in een veilige, goed gesloten container, uit de buurt van ontstekingsbronnen, hitte of vocht. De juiste hanteringsprocedures en veiligheidsmaatregelen moeten worden gevolgd om de risico’s die verband houden met chloorheptoxide te minimaliseren.
| Gevarensymbolen | Oxidatiemiddel, bijtend |
| Beveiligingsbeschrijving | Vermijd contact met water, zuren, organische materialen en reductiemiddelen. Gebruik geschikte persoonlijke beschermingsmiddelen. Bewaren in een goed gesloten verpakking, verwijderd van hitte, vocht en ontstekingsbronnen. In geval van contact met de ogen, de huid of de luchtwegen, dient u onmiddellijk medische hulp in te roepen. |
| VN-identificatienummers | VN 3083 |
| HS-code | 28299090 |
| Gevarenklasse | 5.1 (Oxiderende materialen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig bij inademing, inslikken of opname door de huid. Veroorzaakt ernstige brandwonden en weefselschade. Kan explosies en brandgevaar veroorzaken bij contact met water, organische materialen en andere reactieve stoffen. |
Methoden voor de synthese van chloorheptoxide
Chloorheptoxide is een zeer reactieve verbinding en moeilijk te synthetiseren.
Een van de meest gebruikelijke methoden voor het synthetiseren van chloorheptoxide is door chloorgas en ozon te laten reageren. Deze reactie is exotherm en kan tot een explosieve reactie leiden als deze niet zorgvuldig wordt gecontroleerd.
Een andere methode omvat de reactie van chloorgas met kaliumchloraat, waarbij chloorheptoxide en kaliumchloride als bijproducten ontstaan. Deze methode vereist ook een zorgvuldige controle van de reactieomstandigheden om de vorming van explosieve tussenproducten te voorkomen.
Chloorheptoxide kan worden gesynthetiseerd door chloorgas te laten reageren met dichloorpentoxide, waarbij chloorheptoxide en dichloorhexoxide als bijproducten ontstaan. Onderzoekers gebruiken deze methode echter niet vaak vanwege de gevaarlijke aard van dichloorpentoxide.
Andere methoden voor het synthetiseren van chloorheptoxide zijn onder meer het laten reageren van chloorgas met verschillende organische verbindingen, zoals benzeen of tolueen, onder gecontroleerde omstandigheden. Deze methoden vereisen echter een zorgvuldige optimalisatie van de reactieomstandigheden en zijn niet zo betrouwbaar of algemeen gebruikt als de chloor-ozon- of chloor-kaliumchloraatmethoden.
Over het geheel genomen vereist de synthese van chloorheptoxide een zorgvuldige controle van de reactieomstandigheden en brengt aanzienlijke veiligheidsrisico’s met zich mee vanwege de zeer reactieve aard van de verbinding. Veiligheidsmaatregelen en juiste hanteringsprocedures moeten worden gevolgd bij het werken met chloorheptoxide of andere gevaarlijke stoffen.
Gebruik van chloorheptoxide
- Cl2O7 wordt vooral gebruikt als oxidatiemiddel bij chemische synthese en onderzoek.
- Het werkt als een krachtig oxidatiemiddel en reageert met een breed scala aan organische en anorganische verbindingen, waardoor het bruikbaar is bij veel chemische reacties.
- Een van de meest voorkomende toepassingen van Cl2O7 is de productie van chloordioxide, een krachtig ontsmettings- en bleekmiddel dat wordt gebruikt bij waterbehandeling, pulp- en papierproductie en textielproductie.
- Het wordt ook gebruikt als krachtig oxidatiemiddel bij de synthese van verschillende organische verbindingen, waaronder farmaceutische producten en landbouwchemicaliën.
- Cl2O7 wordt in de academische wereld en in onderzoek gebruikt om de reactiviteit van verschillende organische en anorganische verbindingen te bestuderen. Het dient ook als katalysator bij de synthese van bepaalde verbindingen, zoals epoxyharsen en azijnzuuranhydride.
- Vanwege het gevaarlijke karakter ervan maken grootschalige industriële toepassingen doorgaans geen gebruik van Cl2O7. Het vereist een zorgvuldige behandeling en opslag om de vorming van explosieve tussenproducten en andere veiligheidsrisico’s te voorkomen.
Over het geheel genomen is Cl2O7 een nuttige verbinding bij chemische synthese en onderzoek, maar er zijn veiligheidsmaatregelen en juiste hanteringsprocedures voor nodig om de risico’s die aan het gebruik ervan zijn verbonden tot een minimum te beperken.
Vragen:
Vraag: Wat is Cl2O7?
A: Cl2O7 is een chemische verbinding bestaande uit twee chlooratomen en zeven zuurstofatomen, met de chemische formule Cl2O7.
Vraag: Wat is de juiste naam voor Cl2O7?
A: De juiste naam voor Cl2O7 is dichloorheptoxide.
Vraag: Is Cl2O7 ionisch of covalent?
A: Cl2O7 is een covalente verbinding. Het is samengesteld uit twee niet-metalen elementen, chloor en zuurstof, en vormt een moleculaire verbinding door het delen van elektronen tussen atomen.
Vraag: Welk oxide hieronder reageert met water en vormt een zwak zuur? MgO, Cl2O7, P4O10, Bi2O3, N2O5.
A: Het oxide dat met water reageert en een zwak zuur vormt, is N2O5. Wanneer N2O5 reageert met water, vormt het salpeterzuur, een zwak zuur. De andere genoemde oxiden, MgO, P4O10, Bi2O3 en Cl2O7, reageren niet met water en vormen zwakke zuren.
