Stikstoftrifluoride of NF3 is een krachtig broeikasgas dat in de elektronica-industrie wordt gebruikt voor plasma-etsen en reinigen. Het heeft een lange atmosferische levensduur en draagt bij aan de klimaatverandering.
| IUPAC-naam | Stikstoftrifluoride |
| Moleculaire formule | NF3 |
| CAS-nummer | 7783-54-2 |
| Synoniemen | Trifluoramine, stikstoffluoride (NF3), stikstoffluoride (1:3), stikstoffluoride (NF3), stikstof(III)fluoride, stikstoffluoride, tablet, UN 2451 |
| InChi | InChI=1S/F3N/c1-4(2)3 |
Stikstoftrifluoride Molaire massa
De molaire massa van NF3 is 71,0 g/mol. Dit betekent dat één mol NF3 6.022 x 10^23 moleculen bevat.
Kookpunt van stikstoftrifluoride
NF3 heeft een kookpunt van -129,04°C of -200,27°F. Dit is relatief laag in vergelijking met andere gassen, waardoor het gemakkelijker te hanteren is in industriële toepassingen.
Stikstoftrifluoride Smeltpunt
Stikstoftrifluoride heeft een smeltpunt van -206,73°C of -340,11°F. Dit betekent dat NF3 zich bij kamertemperatuur in een gasvormige toestand bevindt.
NF3 Dichtheid g/ml
De dichtheid van NF3 is 1,88 g/ml bij standaardtemperatuur en -druk. Dit betekent dat stikstoftrifluoride een grotere dichtheid heeft dan lucht en naar de grond zal zinken als het in de atmosfeer terechtkomt.
Stikstoftrifluoride Molecuulgewicht
Het molecuulgewicht van NF3 bedraagt 71,0 g/mol. Het is de som van de atoomgewichten van stikstof en fluor in de verbinding.
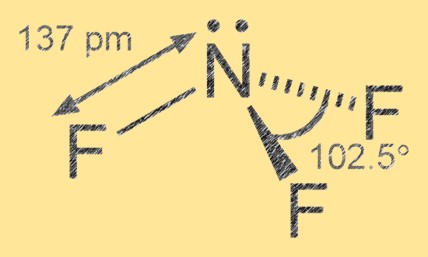
Structuur van stikstoftrifluoride
Stikstoftrifluoride heeft een trigonale piramidale moleculaire geometrie met stikstof als het centrale atoom en drie fluoratomen eromheen. De stikstof-fluorbinding is polair covalent, waarbij de fluoratomen elektronegatiever zijn dan de stikstof, wat leidt tot een gedeeltelijke negatieve lading op de fluoratomen en een gedeeltelijke positieve lading op het stikstofatoom.
Stikstoftrifluoride-formule
De chemische formule van stikstoftrifluoride is NF3, wat aangeeft dat één molecuul NF3 één stikstofatoom en drie fluoratomen bevat.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 2.62 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 71,0 g/mol |
| Dikte | 1,88 g/ml bij STP |
| Fusie punt | -206,73°C of -340,11°F |
| Kookpunt | -129,04°C of -200,27°F |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 0,41 g/100 ml bij 25°C |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 315 kPa bij 20°C |
| Dampdichtheid | 2,01 (lucht = 1) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van stikstoftrifluoride
Stikstoftrifluoride (NF3) wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld, maar het kan bij onjuist gebruik verschillende gevaren met zich meebrengen. Het kan huid- en oogirritatie veroorzaken en inademing van hoge concentraties kan ademhalingsproblemen veroorzaken. NF3-gas kan in slecht geventileerde ruimtes zuurstof verdringen, wat tot verstikking kan leiden. Het is ook een krachtig broeikasgas dat bijdraagt aan de klimaatverandering. Bij brand kan NF3 het giftige waterstoffluoridegas vrijgeven. Het is essentieel om de juiste veiligheidsprotocollen te volgen, inclusief adequate ventilatie en het gebruik van beschermende uitrusting, bij het hanteren van NF3 om deze gevaren te voorkomen.
| Gevarensymbolen | T, C |
| Beveiligingsbeschrijving | Vermijd inademing en contact met huid en ogen. Alleen gebruiken in goed geventileerde ruimtes. |
| VN-identificatienummers | VN2451 |
| HS-code | 28129090 |
| Gevarenklasse | 2.3 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van stikstoftrifluoride
Er bestaan verschillende methoden om stikstoftrifluoride (NF3) te synthetiseren:
Een gebruikelijke methode omvat de reactie van watervrije ammoniak (NH3) met fluorgas (F2) in aanwezigheid van een katalysator zoals ijzer, nikkel of platina. De reactie produceert NF3 en waterstoffluoride (HF). Industrieën gebruiken deze methode vaak voor de productie van NF3.
Een andere methode omvat de thermische ontleding van ammoniumfluoride (NH4F) bij hoge temperaturen. Bij de reactie ontstaan NF3 en ammoniakgas (NH3). De reactie van NH3 met F2 is efficiënter dan deze methode en wordt daarom minder vaak gebruikt.
Een andere methode omvat de reactie van stikstofoxide (NO) met fluorgas in aanwezigheid van een katalysator. Bij de reactie ontstaan de gassen NF3 en stikstofdioxide (NO2).
NF3 kan ook elektrochemisch worden gesynthetiseerd door een elektrische ontlading door een mengsel van N2- en F2-gassen te leiden. Het resulterende plasma vormt NF3 en andere stikstof-fluorverbindingen.
Ongeacht de gebruikte methode is het van cruciaal belang om zeer reactieve en potentieel gevaarlijke reagentia met passende veiligheidsmaatregelen te hanteren. Onderzoekers moeten het syntheseproces echter zorgvuldig controleren om een hoge opbrengst en zuiverheid van het eindproduct te garanderen.
Gebruik van stikstoftrifluoride
Stikstoftrifluoride (NF3) heeft vanwege zijn unieke eigenschappen diverse industriële toepassingen.
- De halfgeleiderindustrie gebruikt NF3 als reinigingsmiddel voor siliciumwafels. NF3 wordt ook gebruikt bij de productie van platte beeldschermen, zonnecellen en micro-elektromechanische systemen (MEMS).
- Bij de productie van elektronische componenten wordt NF3 gebruikt als plasma-etsgas. Het vertoont een hoge reactiviteit en verwijdert selectief bepaalde materialen terwijl andere intact blijven.
- Koelsystemen gebruiken NF3 ook als koelmiddel vanwege het lagere aardopwarmingsvermogen dan andere koelmiddelen, waardoor het een milieuvriendelijkere optie is.
- De lucht- en ruimtevaartindustrie gebruikt NF3 als drijfgas vanwege de hoge specifieke impuls, die een efficiënte voortstuwing van ruimtevaartuigen mogelijk maakt.
Ondanks de vele toepassingen zijn er zorgen over de milieueffecten van NF3. Het is een krachtig broeikasgas met een lange levensduur in de atmosfeer. De productie en het gebruik van NF3 kunnen bijdragen aan de klimaatverandering als de juiste voorzorgsmaatregelen niet worden genomen. Daarom worden er inspanningen geleverd om het gebruik ervan te verminderen en duurzamere alternatieven te ontwikkelen.
Vragen:
Vraag: Is stikstoftrifluoride (NF3) polair?
A: Ja, NF3 is polair. Het heeft een trigonale piramidale moleculaire geometrie, met het stikstofatoom in het midden en drie fluoratomen eromheen. De asymmetrische vorm van het molecuul veroorzaakt een ongelijkmatige verdeling van de elektronendichtheid, wat resulteert in een polair molecuul.
Vraag: Wat is de formule voor stikstoftrifluoride?
A: De formule voor stikstoftrifluoride is NF3, wat aangeeft dat het molecuul uit één stikstofatoom en drie fluoratomen bestaat.
Vraag: Waar komt stikstoftrifluoride vandaan?
A: NF3 kan op verschillende manieren worden geproduceerd, waaronder de reactie van watervrije ammoniak met fluorgas, thermische ontleding van ammoniumfluoride en elektrochemische synthese. Het wordt vaak gebruikt in de halfgeleiderindustrie als schoonmaakmiddel en bij de productie van elektronische componenten en ruimtevaartmotoren.
Vraag: Lewis-structuur van stikstoftrifluoride?
A: De Lewis-structuur voor NF3 bestaat uit een stikstofatoom dat via enkele covalente bindingen aan drie fluoratomen is gekoppeld. Er zit ook een paar niet-bindende elektronen op het stikstofatoom, waardoor het molecuul een trigonale piramidevorm krijgt.
Vraag: Intermoleculaire krachten van stikstoftrifluoride?
A: De intermoleculaire krachten van NF3 omvatten dipool-dipoolinteracties, die voortvloeien uit de polaire aard van het molecuul. Het moleculair experimenteert ook met Londense dispersiekrachten, dit zijn zwakke intermoleculaire krachten die het gevolg zijn van tijdelijke fluctuaties in de elektronendichtheid.
Vraag: Is NF3 polair of niet-polair?
A: NF3 is polair vanwege zijn asymmetrische vorm en ongelijkmatige verdeling van de elektronendichtheid. Het molecuul heeft een dipoolmoment, wat aangeeft dat het een positief en een negatief uiteinde heeft, waardoor het een polair molecuul is.
