Mierenzuur of HCOOH is een kleurloze vloeistof met een scherpe geur. Het wordt veel gebruikt als conserveermiddel en antibacterieel middel en bij de vervaardiging van leer, textiel en rubber.
| IUPAC-naam | Methaanzuur |
| Moleculaire formule | HCOOH |
| CAS-nummer | 64-18-6 |
| Synoniemen | Waterstofcarbonzuur, formylzuur, aminozuur, formylzuur, metakoolzuur, thionylmierenzuur, enz. |
| InChi | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
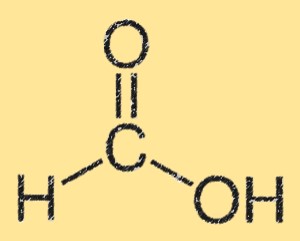
Structuur van mierenzuur
De structuur van mierenzuur wordt gekenmerkt door een carbonzuurgroep (-COOH) gebonden aan een enkel koolstofatoom. Het koolstofatoom is ook gebonden aan een waterstofatoom en een zuurstofatoom. De structuur van mierenzuur is vlak en heeft waterstofbruggen tussen de carbonzuurgroepen. De waterstofbrug zorgt voor een hoge oplosbaarheid in water.
Mierenzuurformule
De chemische formule voor mierenzuur is HCOOH. Het is een eenvoudige organische verbinding die één koolstofatoom, één zuurstofatoom en twee waterstofatomen bevat. De formule van mierenzuur is belangrijk bij het bepalen van de chemische en fysische eigenschappen ervan, evenals het gedrag ervan onder verschillende omstandigheden. Het wordt ook gebruikt in verschillende chemische berekeningen, zoals stoichiometrie en molariteit.
Lewis-structuur HCOOH
De Lewis-structuur van mierenzuur (HCOOH) is als volgt:
H
|
C=O
|
OH
Het koolstofatoom bevindt zich in het midden van de structuur met vier valentie-elektronen. Het vormt enkele bindingen met de twee waterstofatomen en het zuurstofatoom, dat twee paar vrije elektronen heeft. Het zuurstofatoom vormt ook een dubbele binding met het andere koolstofatoom, dat een paar vrije elektronen draagt. De Lewis-structuur laat zien dat het molecuul een polaire covalente binding heeft vanwege het verschil in elektronegativiteit tussen de koolstof- en zuurstofatomen.
Mierenzuur molaire massa
De molaire massa van mierenzuur, ook wel methaanzuur genoemd, is 46,03 g/mol. De chemische formule is HCOOH, wat aangeeft dat het één koolstofatoom, één zuurstof- en twee waterstofatomen bevat. Molaire massa is een belangrijke parameter voor het bepalen van de hoeveelheid van een stof die nodig is om een oplossing met een specifieke concentratie te bereiden. Om bijvoorbeeld een 1 M oplossing van mierenzuur te bereiden, zou het nodig zijn om 46,03 g mierenzuur op te lossen in 1 liter oplosmiddel.
Kookpunt van mierenzuur
Het kookpunt van HCOOH is 100,8°C (213,4°F). Het is een kleurloze vloeistof met een scherpe geur en zeer oplosbaar in water. Het kookpunt van HCOOH is relatief laag, wat betekent dat het gemakkelijk kan worden verdampt en gedestilleerd. Deze eigenschap maakt het bruikbaar in verschillende industriële toepassingen, zoals de productie van kleurstoffen, kunststoffen en farmaceutische producten.
HCOOH Smeltpunt
Het smeltpunt van HCOOH is 8,4°C (47,1°F). Het is een vaste stof bij kamertemperatuur en kan in zuivere vorm worden verkregen door het tot onder het smeltpunt af te koelen. HCOOH-kristallen zijn wit en geven een scherpe geur af. Het smeltpunt van HCOOH is relatief laag in vergelijking met andere carbonzuren, waardoor het een nuttig oplosmiddel is voor bepaalde chemische reacties.
HCOOH-dichtheid g/ml
De dichtheid van HCOOH is 1.220 g/ml bij 25°C (77°F). Het is dichter dan water, dat bij dezelfde temperatuur een dichtheid heeft van 1000 g/ml. De dichtheid van HCOOH is een belangrijke eigenschap die de oplosbaarheid ervan in water en andere oplosmiddelen bepaalt. Dit heeft ook invloed op het gedrag onder verschillende omstandigheden, zoals temperatuur en druk.
Molecuulgewicht van mierenzuur
Het molecuulgewicht van mierenzuur is 46,03 g/mol. Het is een eenvoudige organische verbinding met de chemische formule HCOOH. Het molecuulgewicht is een belangrijke parameter voor het bepalen van de fysische en chemische eigenschappen van een stof. Het wordt gebruikt om verschillende grootheden te berekenen, zoals het aantal mol, de massa en het volume van een stof.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1.22 |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 46,03 g/mol |
| Dikte | 1.220 g/ml |
| Fusie punt | 8,4°C |
| Kookpunt | 100,8°C |
| Flitspunt | 68°C |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in de meeste organische oplosmiddelen |
| Dampdruk | 44,5 mmHg |
| Dampdichtheid | 1,5 (lucht=1) |
| pKa | 3,75 |
| pH | 2.4 |
Veiligheid en gevaren van mierenzuur
HCOOH brengt verschillende veiligheids- en gevarenrisico’s met zich mee. Het is een zeer bijtende en giftige stof die bij contact ernstige brandwonden en oogletsel kan veroorzaken. Inademing van HCOOH-dampen kan irritatie van de luchtwegen en longschade veroorzaken. Het is ook brandbaar en kan ontbranden bij hoge temperaturen, waardoor brandgevaar ontstaat. Bij het hanteren van HCOOH moeten passende veiligheidsmaatregelen worden genomen, inclusief het gebruik van beschermende kleding, handschoenen en oogbescherming. Het moet worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen, zoals oxidatiemiddelen en alkaliën.
| Gevarensymbolen | Bijtend, giftig |
| Beveiligingsbeschrijving | Draag beschermende handschoenen en oog-/gezichtsbescherming. Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. |
| VN-identificatienummers | VN1779 |
| HS-code | 2915.11.00 |
| Gevarenklasse | 8 (corrosief) |
| Verpakkingsgroep | II (gemiddeld) |
| Toxiciteit | LD50 1,8 g/kg (oraal, rat) |
Methoden voor de synthese van mierenzuur
Mierenzuur kan op verschillende manieren worden gesynthetiseerd.
- Een gebruikelijke methode omvat de reactie van koolmonoxide en water in aanwezigheid van een katalysator, zoals rhodium of kobalt. Dit is het Formox-proces. Bij dit proces ontstaan mierenzuur en waterstofgas.
- Een andere methode omvat de oxidatie van formaldehyde met behulp van een sterk oxidatiemiddel, zoals chroomzuur of kaliumpermanganaat, onder zure omstandigheden. Bij deze reactie ontstaan mierenzuur en water.
- Eén manier om mierenzuur te synthetiseren is door natriumformiaat te laten reageren met zwavelzuur. Deze reactie resulteert in de vorming van mierenzuur en natriumsulfaat als bijproduct.
- Mieren produceren mierenzuur als een natuurlijk afweermechanisme, en het kan via destillatie uit hun lichaam worden verkregen.
- Een andere methode voor het synthetiseren van HCOOH omvat het laten reageren van kooldioxide met waterstof in aanwezigheid van een katalysator, zoals koperchromiet of zinkoxide. Dit proces, bekend als de HCOOH-synthesereactie, produceert HCOOH en water.
- HCOOH kan ook worden verkregen uit natuurlijke bronnen, zoals brandnetelbladeren, waar het in kleine hoeveelheden aanwezig is.
Over het algemeen zijn er verschillende methoden beschikbaar voor de synthese van HCOOH, die elk hun voor- en nadelen hebben.
Gebruik van mierenzuur
Mierenzuur kent een breed scala aan toepassingen in diverse industrieën.
- Het vermogen om de groei van schadelijke micro-organismen te voorkomen, maakt mierenzuur tot een veel voorkomende keuze als conserveermiddel en antibacterieel middel in veevoer en kuilvoer.
- Het helpt de groei van schadelijke micro-organismen in voer en kuilvoer tegen te gaan, waardoor het een nuttig additief is.
- De textielindustrie gebruikt mierenzuur als verf- en afwerkingsmiddel voor stoffen om de kleurechtheid te verbeteren en de affiniteit van kleurstoffen voor vezels te vergroten.
- Mierenzuur dient als oplosmiddel en tussenproduct bij de productie van verschillende chemicaliën zoals azijnzuur, formamide en methanol.
- Mierenzuur is een looimiddel dat in de leerindustrie wordt gebruikt en dat de textuur en duurzaamheid van lederen producten helpt verbeteren.
- Bij de rubberproductie helpt mierenzuur het vulkanisatieproces door als coagulatiemiddel te dienen.
- De farmaceutische industrie gebruikt mierenzuur als conserveermiddel voor vaccins en als desinfectiemiddel voor medische apparatuur.
- Bovendien vindt mierenzuur toepassingen bij de productie van verschillende medicijnen, waaronder diuretica en antihistaminica.
- Mierenzuur is een reductiemiddel bij organische synthesereacties en een katalysator bij polymerisatiereacties.
- Mierenzuur helpt het aroma van verschillende producten te versterken, waardoor het bruikbaar wordt bij de productie van smaak- en geurstoffen.
Over het algemeen is de diversiteit aan toepassingen van mierenzuur in verschillende industrieën te danken aan de unieke eigenschappen en veelzijdige aard ervan.
Vragen:
V. Is mierenzuur een sterk zuur?
A. Mierenzuur is een zwak zuur, met een pKa-waarde van ongeveer 3,75. Dit betekent dat het niet volledig dissocieert in water en een zwakker zuur is dan sterke zuren zoals zoutzuur of zwavelzuur.
V. Wat is zuurder mierenzuur of azijnzuur?
A. Mierenzuur is zuurder dan azijnzuur. Dit komt door de aanwezigheid van een methylgroep in azijnzuur die de negatieve lading op de geconjugeerde base stabiliseert, waardoor het minder waarschijnlijk is dat deze dissocieert. Aan de andere kant heeft mierenzuur een kleinere moleculaire grootte en een sterker elektronegatief atoom (zuurstof), waardoor het gemakkelijker dissocieert en zuurder wordt.
V. Door welke mier wordt mierenzuur geproduceerd?
A. Mierenzuur wordt geproduceerd door verschillende soorten mieren, waaronder houtmieren, vuurmieren en sommige soorten angelloze bijen. Het zuur wordt opgeslagen in het lichaam van de mier en wordt gebruikt als verdedigingsmechanisme tegen roofdieren. Wanneer de mier wordt bedreigd, kan hij mierenzuur uit zijn angel schieten of dit via gespecialiseerde klieren in zijn lichaam vrijgeven.
