Bariumhydroxide is een chemische verbinding met de formule Ba(OH)2. Het is een witte kristallijne vaste stof die zeer oplosbaar is in water en vaak wordt gebruikt in laboratoria en industriële processen.
| IUPAC-naam | Bariumdihydroxide |
| Moleculaire formule | Ba(OH)2 |
| CAS-nummer | 17194-00-2 |
| Synoniemen | Barium (II) hydroxide, bariet, bariumhydraat, bariumdihydraat, bis (bariumhydroxide), bis (oxydanyl) bariumhydraat |
| InChi | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Molaire massa van bariumhydroxide
Bariumhydroxide heeft een molaire massa van 171,34 g/mol. Het bestaat uit één bariumion (Ba2+) en twee hydroxide-ionen (OH-), elk met een molaire massa van respectievelijk 137,33 g/mol en 17,01 g/mol. De molmassa van bariumhydroxide is belangrijk voor het bepalen van de hoeveelheid verbinding die nodig is voor reacties of voor het berekenen van de concentratie van een oplossing.
Bariumhydroxide-formule
De chemische formule voor bariumhydroxide is Ba(OH)2. Het bestaat uit één bariumion (Ba2+) en twee hydroxide-ionen (OH-). De bariumhydroxideformule is belangrijk voor het bepalen van de hoeveelheid verbinding die nodig is bij reacties of voor het berekenen van de concentratie van een oplossing. Het wordt ook gebruikt om de structuur van de verbinding en zijn gedrag in oplossing weer te geven.
Kookpunt van Ba(OH)2
Het kookpunt van Ba(OH)2 is niet goed gedefinieerd, omdat het ontleedt voordat het wordt gekookt. Ba(OH)2 is een sterke base en reageert gemakkelijk met kooldioxide in de lucht, waarbij bariumcarbonaat en water worden gevormd. De ontledingstemperatuur van Ba(OH)2 hangt af van de concentratie van de oplossing, maar ligt doorgaans boven de 780°C.
Ba(OH)2-smeltpunt
Ba(OH)2 heeft een smeltpunt van 407°C. Het bestaat in vaste toestand in de vorm van witte, geurloze kristallen. Bij verhitting ondergaat Ba(OH)2 een omkeerbare reactie waarbij bariumoxide en water worden gevormd. Het smeltpunt van Ba(OH)2 is belangrijk bij het bepalen van de temperatuur waarbij het veilig kan worden gehanteerd en opgeslagen.
Ba(OH)2 dichtheid g/ml
De dichtheid van de vaste stof Ba(OH)2 bedraagt 3,22 g/cm3. In oplossing varieert de dichtheid afhankelijk van de concentratie. Een 10% oplossing van Ba(OH)2 heeft bijvoorbeeld een dichtheid van 1,17 g/cm3. De dichtheid van Ba(OH)2 is belangrijk bij het bepalen van het volume van een oplossing dat nodig is voor reacties of bij het hanteren van de verbinding.
Ba(OH)2-molecuulgewicht
Het molecuulgewicht van Ba(OH)2 bedraagt 171,34 g/mol. Het is de som van de atoomgewichten van één bariumion en twee hydroxide-ionen. Het molecuulgewicht van Ba(OH)2 is belangrijk voor het bepalen van de hoeveelheid verbinding die nodig is bij reacties of voor het berekenen van de concentratie van een oplossing.
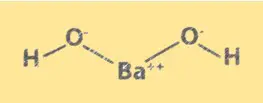
Structuur Ba(OH)2
Ba(OH)2 heeft een kristalstructuur die lijkt op natriumchloride. Het bestaat uit Ba2+-ionen en OH–ionen, gerangschikt in een kubisch rooster. De Ba2+-ionen bezetten de hoeken van de kubus en de OH-ionen het midden van elk vlak. De structuur van Ba(OH)2 is belangrijk voor het begrijpen van de chemische eigenschappen en het gedrag ervan in oplossing.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 3,22 g/cm3 (vast) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 171,34 g/mol |
| Dikte | 2,18 g/cm3 (waterige oplossing, 10% w/w bij 25°C) |
| Fusie punt | 407°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in alcohol en aceton |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch (pH > 7) |
Let op: De waarden in deze tabel zijn algemene beschrijvingen en kunnen variëren afhankelijk van specifieke omstandigheden en concentraties van de stof.
Bariumhydroxideveiligheid en gevaren
Ba(OH)2 is een zeer bijtende en giftige stof die ernstige irritatie aan de huid, ogen en luchtwegen kan veroorzaken. Het is belangrijk om er voorzichtig mee om te gaan en geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en een veiligheidsbril. Bij inademing of inslikken kan het ernstige schade aan de longen, het spijsverteringsstelsel en de nieren veroorzaken. Het moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen zoals zuren en oxidatiemiddelen. In geval van lekkage of blootstelling dient u de juiste noodprocedures te volgen, zoals het evacueren van het gebied en het onmiddellijk inroepen van medische hulp.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen; Draag beschermende kleding en handschoenen; Alleen gebruiken in goed geventileerde ruimtes |
| AN-identificaties | VN 1564 |
| HS-code | 2816.40.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken, inademen en opname door de huid; Veroorzaakt ernstige huid- en oogirritatie; Kan irritatie van de luchtwegen en nierschade veroorzaken |
Methoden voor de synthese van bariumhydroxide
Ba(OH)2 kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van bariumoxide (BaO) met water (H2O) of de reactie van bariumchloride (BaCl2) met natriumhydroxide (NaOH).
Bij de eerste methode wordt bariumoxide onder voortdurend roeren langzaam aan gedestilleerd water toegevoegd totdat de gewenste concentratie is bereikt. De resulterende oplossing wordt vervolgens gefiltreerd en gedroogd om de vaste vorm van Ba(OH)2 te verkrijgen.
Bij de tweede methode wordt onder voortdurend roeren een bariumchlorideoplossing langzaam toegevoegd aan een natriumhydroxideoplossing totdat de gewenste pH is bereikt. De resulterende oplossing wordt vervolgens gefiltreerd en gedroogd om de vaste vorm van Ba(OH)2 te verkrijgen.
Een andere methode omvat de reactie van bariumsulfide (BaS) met water, waarbij Ba(OH)2 en waterstofsulfidegas (H2S) worden geproduceerd.
Ba(OH)2 kan ook worden bereid door elektrolyse van gesmolten bariumzouten of door thermische ontleding van bariumcarbonaat (BaCO3) bij hoge temperatuur.
Over het geheel genomen vereist de synthese van Ba(OH)2 een zorgvuldige omgang en passende veiligheidsmaatregelen vanwege de zeer bijtende en toxische eigenschappen ervan. Het is belangrijk om de juiste veiligheidsprotocollen en -voorschriften te volgen bij het werken met gevaarlijke materialen.
Gebruik van bariumhydroxide
Ba(OH)2 heeft verschillende industriële en laboratoriumtoepassingen vanwege zijn zeer reactieve aard en alkalische eigenschappen. Een van de belangrijkste toepassingen is als chemisch reagens bij de productie van verschillende chemicaliën, waaronder smeermiddelen, kunststoffen en pesticiden.
Ba(OH)2 wordt ook gebruikt als stabilisator in PVC en andere kunststoffen om verkleuring en afbraak door hitte en blootstelling aan UV-straling te voorkomen. Het wordt ook gebruikt bij de productie van bepaalde glassoorten, zoals optisch glas en glas met een hoge brekingsindex.
In het laboratorium wordt Ba(OH)2 gebruikt als katalysator bij verschillende organische reacties, zoals veresterings- en heresteringsreacties. Het wordt ook gebruikt als titrant in de analytische chemie voor de bepaling van zwakke zuren en bij de bereiding van standaardoplossingen.
Een andere toepassing van Ba(OH)2 is de productie van bariumoxide, dat wordt gebruikt bij de vervaardiging van kathodestraalbuizen voor televisies en computermonitors.
Ba(OH)2 wordt ook gebruikt bij de behandeling van industrieel afvalwater om onzuiverheden te verwijderen en zure of alkalische afvalwateren te neutraliseren voordat het in het milieu wordt geloosd.
Over het geheel genomen speelt Ba(OH)2 een essentiële rol in veel industrieën en laboratoria en draagt het bij aan de productie van veel producten en processen.
Vragen:
Is bariumhydroxide oplosbaar?
Ja, bariumhydroxide is in water oplosbaar. Wanneer het in water wordt opgelost, vormt het een alkalische oplossing met een pH van ongeveer 12,5. De oplosbaarheid van Ba(OH)2 in water is relatief hoog, met een oplosbaarheid van ongeveer 3,52 g/100 ml bij kamertemperatuur (25 °C). De oplosbaarheid van Ba(OH)2 kan worden beïnvloed door factoren als temperatuur, druk en de aanwezigheid van andere stoffen in de oplossing.
Is bariumhydroxide een sterke base?
Ja, bariumhydroxide is een sterke base. Wanneer het in water wordt opgelost, dissocieert het volledig en vormt in de oplossing bariumionen (Ba2+) en hydroxide-ionen (OH-). Deze dissociatie produceert een zeer alkalische oplossing met een pH van ongeveer 12,5. De sterke basische eigenschappen van Ba(OH)2 maken het tot een effectieve neutralisator van zure effluenten en een katalysator bij diverse organische reacties.
Wat is de formule voor bariumhydroxide?
De formule voor bariumhydroxide is Ba(OH)2. Deze formule geeft aan dat elk molecuul bariumhydroxide één bariumion (Ba2+) en twee hydroxide-ionen (OH-) bevat. Het bariumion heeft een lading van +2, terwijl het hydroxide-ion een lading van -1 heeft. De twee hydroxide-ionen in Ba(OH)2 brengen de +2 lading van het bariumion in evenwicht, waardoor een neutrale verbinding ontstaat. De formule van Ba(OH)2 is belangrijk voor het begrijpen van de eigenschappen en reacties ervan, maar ook voor het berekenen van de molaire massa en andere fysisch-chemische eigenschappen.
