Acetylchloride of C2H3ClO is een kleurloze, rokende vloeistof met een scherpe geur. Het wordt voornamelijk gebruikt als reagens bij de organische synthese en als acetyleringsmiddel bij de productie van farmaceutische producten en kleurstoffen.
| UPAC-naam | Acetylchloride |
| Moleculaire formule | C2H3ClO |
| CAS-nummer | 75-36-5 |
| Synoniemen | Ethanoylchloride, azijnzuurchloride, azijnchloride, chlooracetylchloride, AcCl |
| InChi | InChI=1S/C2H3ClO/c1-2(3)4/h1H3 |
Eigenschappen van acetylchloride
Acetylchloride Molaire massa
Acetylchloride, met de chemische formule C2H3ClO, heeft een molaire massa van ongeveer 78,50 g/mol. Dit wordt berekend door de atoommassa’s van elk atoom in het molecuul op te tellen, namelijk koolstof (12,01 g/mol), waterstof (1,01 g/mol), chloor (35,45 g/mol) en zuurstof (16,00 g/mol). De molaire massa van acetylchloride is belangrijk bij stoichiometrische berekeningen voor het bepalen van de hoeveelheid reactanten en producten in chemische reacties.
Kookpunt van acetylchloride
Het kookpunt van acetylchloride is 51,5°C (124,7°F) bij standaard atmosferische druk. Dit lage kookpunt, in combinatie met het zeer reactieve karakter ervan, betekent dat acetylchloride in het laboratorium met voorzichtigheid moet worden gehanteerd. Het is een kleurloze, rokende vloeistof met een scherpe geur die zeer oplosbaar is in polaire oplosmiddelen zoals ethanol en aceton.
Smeltpunt van acetylchloride
C2H3ClO heeft een smeltpunt van -112,1°C (-169,8°F) bij standaard atmosferische druk. Dit maakt het een zeer vluchtige en reactieve verbinding die zorgvuldige behandeling en opslag vereist.
Dichtheid van acetylchloride g/ml
Acetylchloride heeft een dichtheid van 1,104 g/ml bij 25°C (77°F). Dit betekent dat C2H3ClO een grotere dichtheid heeft dan water en erin zal zinken. De dichtheid van C2H3ClO is belangrijk bij het bepalen hoeveel materiaal in een bepaald volume kan worden opgeslagen, evenals bij de passende veiligheidsmaatregelen die nodig zijn om het materiaal te hanteren en op te slaan.
Acetylchloride Molecuulgewicht
Het molecuulgewicht van C2H3ClO is 78,50 g/mol. Deze waarde is belangrijk voor het bepalen van de hoeveelheid C2H3ClO die nodig is bij chemische reacties en voor het omrekenen tussen verschillende meeteenheden.
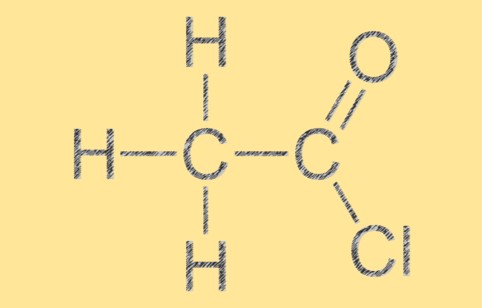
Structuur van acetylchloride
Acetylchloride heeft een trigonale vlakke moleculaire geometrie, waarbij het koolstofatoom in het midden wordt omringd door drie andere atomen in een platte driehoekige opstelling. Het molecuul heeft een dubbele C=O-binding tussen de koolstof- en zuurstofatomen en een enkele binding tussen de koolstof- en chlooratomen. De moleculaire structuur van C2H3ClO geeft het zijn karakteristieke reactiviteit en chemische eigenschappen.
Acetylchloride-formule
De chemische formule voor acetylchloride is C2H3ClO, wat het aantal en het type atomen in het molecuul weergeeft. De formule is belangrijk voor stoichiometrische berekeningen bij chemische reacties en voor het identificeren van de verbinding in het laboratorium. C2H3ClO wordt voornamelijk gebruikt als reagens bij de organische synthese en als acetyleringsmiddel bij de productie van farmaceutische producten en kleurstoffen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,104 g/ml bij 25°C |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 78,50 g/mol |
| Dikte | 1,104 g/ml bij 25°C |
| Fusie punt | -112,1°C |
| Kookpunt | 51,5°C |
| Flitspunt | -26°C |
| oplosbaarheid in water | Reageert hevig met water |
| Oplosbaarheid | Oplosbaar in de meeste organische oplosmiddelen |
| Dampdruk | 69,7 mmHg bij 25°C |
| Dampdichtheid | 2,7 (lucht=1) |
| pKa | -6,3 |
| pH | Zeer zuur |
Acetylchlorideveiligheid en gevaren
C2H3ClO is een zeer reactieve en gevaarlijke stof die aanzienlijke risico’s voor de menselijke gezondheid en veiligheid met zich meebrengt. Het is een bijtende en giftige stof die bij blootstelling ernstige brandwonden, oogletsel en irritatie van de luchtwegen kan veroorzaken. Acetylchloride kan ook heftig reageren met water, waarbij zoutzuurgas ontstaat, dat irriterend is voor de luchtwegen. Het is belangrijk om uiterst voorzichtig om te gaan met C2H3ClO, de juiste persoonlijke beschermingsmiddelen te dragen en deze uitsluitend in een goed geventileerde ruimte te gebruiken. Een goede opslag, etikettering en transport zijn ook essentieel om ongelukken te voorkomen en een veilige omgang met deze stof te garanderen.
| Gevarensymbolen | Bijtend, giftig |
| Beveiligingsbeschrijving | Adem geen dampen in. Draag beschermende handschoenen en oog-/gezichtsbescherming. Gebruik in geval van brand een CO2-, droogpoeder- of schuimblusser. |
| AN-identificaties | VN1717 |
| HS-code | 2915.90.9000 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig en bijtend. Veroorzaakt ernstige brandwonden aan de huid en ogen. Kan dodelijk zijn bij inademing of inslikken. |
Methoden voor de synthese van acetylchloride
C2H3ClO wordt geproduceerd door azijnzuur te laten reageren met thionylchloride, fosfortrichloride of fosforpentachloride. Deze methoden omvatten het gebruik van zeer reactieve en gevaarlijke reagentia en moeten met uiterste voorzichtigheid worden gebruikt.
De meest gebruikelijke methode voor het synthetiseren van C2H3ClO omvat de reactie van azijnzuur met thionylchloride. Deze methode omvat doorgaans het op een gecontroleerde manier toevoegen van thionylchloride aan azijnzuur, met zorgvuldige temperatuurcontrole om oververhitting en ontleding te voorkomen. Bij de reactie ontstaan C2H3ClO en zwaveldioxidegas als bijproduct.
Een andere methode voor het synthetiseren van C2H3ClO omvat de reactie van azijnzuur met fosfortrichloride of fosforpentachloride. Bij deze methode wordt azijnzuur gemengd met fosfortrichloride of fosforpentachloride en verwarmd om de reactie te starten. De reactie produceert C2H3ClO en fosforzuur als bijproduct.
Het is belangrijk op te merken dat deze methoden het gebruik van zeer reactieve en gevaarlijke chemicaliën met zich meebrengen en alleen mogen worden uitgevoerd door ervaren chemici in een goed geventileerde ruimte met de juiste persoonlijke beschermingsmiddelen. Bovendien moet de synthese van C2H3ClO worden uitgevoerd onder een zuurkast om de blootstelling aan giftige en corrosieve gassen tot een minimum te beperken.
Gebruik van acetylchloride
Acetylchloride is een veelzijdige chemische verbinding die vele toepassingen vindt in de industrie en onderzoek. Enkele veel voorkomende toepassingen van C2H3ClO zijn:
- Productie van farmaceutische producten: Verschillende farmaceutische producten, waaronder pijnstillers, antibiotica en anesthetica, gebruiken C2H3ClO bij hun synthese.
- Productie van kleurstoffen en parfums: Bij de productie van verschillende kleurstoffen en parfums, zoals coumarine dat in parfums en zepen wordt gebruikt, wordt gebruik gemaakt van C2H3ClO.
- Polymeerproductie: De productie van verschillende polymeren zoals polycarbonaat en polyvinylchloride gekoppeld aan C2H3ClO als reactant.
- Productie van geacetyleerde derivaten: C2H3ClO speelt een cruciale rol bij de productie van geacetyleerde derivaten van verbindingen zoals aminozuren en alcohol.
- Chemische reacties: C2H3ClO vertoont een hoge reactiviteit, waardoor het een waardevol reagens is bij verschillende chemische reacties, waaronder acetyleringsreacties en Friedel-Crafts-reacties.
- Laboratoriumonderzoek: C2H3ClO wordt veelvuldig toegepast in laboratoriumonderzoek als reagens voor chemische reacties en als oplosmiddel voor verschillende verbindingen.
Het is belangrijk op te merken dat C2H3ClO een gevaarlijke stof is en dat er met uiterste voorzichtigheid mee moet worden omgegaan. Bij het gebruik van C2H3ClO moeten de juiste veiligheidsprotocollen en -voorschriften worden gevolgd om de risico’s die gepaard gaan met de hantering en het gebruik ervan te minimaliseren.
