Waterstofperoxide of H2O2 is een lichtblauwe vloeistof met sterk oxiderende eigenschappen. Het wordt vaak gebruikt als ontsmettingsmiddel, bleekmiddel en in raketten als drijfgas. In hoge concentraties kan het schadelijk zijn.
| IUPAC-naam | Diwaterstofdioxide |
| Moleculaire formule | H2O2 |
| CAS-nummer | 7722-84-1 |
| Synoniemen | Waterstofdioxide, Peroxide, Oxydol, Superoxol, Hydroniumdioxide, Peroxaan, Asepticper, enz. |
| InChi | InChI=1S/H2O2/c1-2/h1-2H |
Eigenschappen van waterstofperoxide
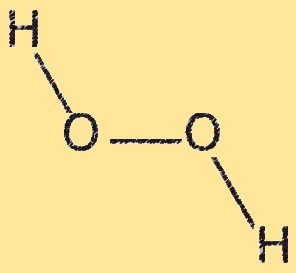
H2O2-structuur
Waterstofperoxide heeft een gebogen moleculaire structuur, met een hoek van ongeveer 104,5 graden tussen de twee zuurstofatomen. Het molecuul heeft twee OH-bindingen en één OO-binding. De OO-binding is zwak en gemakkelijk te verbreken, waardoor waterstofperoxide een sterk oxidatiemiddel is. De gebogen structuur van waterstofperoxide is het resultaat van de afstoting tussen alleenstaande elektronenparen op zuurstofatomen.
Waterstofperoxide-formule
De chemische formule voor waterstofperoxide is H2O2, wat aangeeft dat elk molecuul waterstofperoxide twee waterstofatomen en twee zuurstofatomen bevat. De formule is een beknopte manier om de moleculaire samenstelling van een stof weer te geven. De chemische formule van waterstofperoxide is belangrijk voor het begrijpen van de eigenschappen en reacties met andere stoffen.
Molaire massa waterstofperoxide
Waterstofperoxide heeft een molaire massa van ongeveer 34,01 g/mol. De molaire massa is de som van de atoommassa’s van alle atomen in een molecuul van de verbinding. Waterstofperoxide heeft twee waterstofatomen en twee zuurstofatomen in elk molecuul, dus de molaire massa wordt berekend door de atoommassa van elk atoom op te tellen. Molaire massa is een belangrijke eigenschap van een stof, omdat deze wordt gebruikt bij stoichiometrische berekeningen om de hoeveelheid stof te bepalen die in een bepaald monster aanwezig is.
Kookpunt van waterstofperoxide
Het kookpunt van waterstofperoxide is 150,2°C (302,4°F). Deze temperatuur is het punt waarop de dampdruk van de vloeistof gelijk is aan de atmosferische druk. Boven deze temperatuur verandert de vloeistof in een gas en onder deze temperatuur blijft deze in vloeibare toestand. Het kookpunt van waterstofperoxide is hoger dan dat van water, dat kookt bij 100°C, vanwege de aanwezigheid van intermoleculaire waterstofbruggen in waterstofperoxide.
Smeltpunt van waterstofperoxide
Het smeltpunt van waterstofperoxide is -0,43°C (31,23°F). Deze temperatuur is het punt waarop de vaste en vloeibare toestand van een stof in evenwicht zijn. Bij deze temperatuur smelt de vaste vorm van waterstofperoxide tot een vloeistof. Het smeltpunt van waterstofperoxide is lager dan dat van water, dat smelt bij 0°C, vanwege de onstabiele aard van het waterstofperoxidemolecuul.
Dichtheid van waterstofperoxide g/ml
De dichtheid van waterstofperoxide is 1,11 g/ml bij standaardtemperatuur en druk (STP). Dit betekent dat één milliliter waterstofperoxide 1,11 gram weegt. De dichtheid van waterstofperoxide is groter dan die van water, dat een dichtheid heeft van 1 g/ml, vanwege de aanwezigheid van zwaardere zuurstofatomen in waterstofperoxide.
Waterstofperoxide Molecuulgewicht
Het molecuulgewicht van waterstofperoxide is 34,01 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk atoom in een waterstofperoxidemolecuul op te tellen. Het molecuulgewicht is een belangrijke eigenschap van een stof omdat het wordt gebruikt bij verschillende berekeningen, waaronder het bepalen van de concentratie waterstofperoxide in een oplossing.
| Verschijning | Heldere, kleurloze vloeistof |
| Soortelijk gewicht | 1,11 g/cm3 bij 20°C |
| Kleur | Lichtblauw (pure vorm) |
| Geur | Bijna geurloos (pure vorm) |
| Molaire massa | 34,01 g/mol |
| Dikte | 1,11 g/ml bij 20°C |
| Fusie punt | -0,43°C |
| Kookpunt | 150,2°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig mengbaar met water |
| Oplosbaarheid | Oplosbaar in alcohol, ether en andere organische oplosmiddelen |
| Dampdruk | 23,3 mmHg bij 20°C |
| Dampdichtheid | 1,1 (lucht = 1) |
| pKa | 11,6 (bij 25°C) |
| pH | 4,5 – 6,0 (10% oplossing) |
Let op: Deze waarden zijn typische waarden en kunnen variëren afhankelijk van zuiverheid, concentratie en andere factoren.
Veiligheid en gevaren van waterstofperoxide
Waterstofperoxide kan gevaarlijk zijn als er verkeerd mee wordt omgegaan. Het is een sterk oxidatiemiddel dat heftig kan reageren met organische en anorganische stoffen, waardoor brand of explosies kunnen ontstaan. De geconcentreerde vorm van waterstofperoxide is ook bijtend en kan ernstige brandwonden of weefselschade veroorzaken als het in contact komt met de huid of ogen. Het inademen van waterstofperoxidedampen kan de luchtwegen irriteren en het inslikken ervan kan ernstige inwendige schade of de dood veroorzaken. Daarom moeten passende veiligheidsmaatregelen worden genomen bij het hanteren van waterstofperoxide, zoals het dragen van beschermende kleding en handschoenen, het vermijden van contact met onverenigbare stoffen en het gebruik in een goed geventileerde ruimte.
| Gevarensymbolen | O, C |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en vlammen. Draag beschermende kleding en handschoenen. Vermijd contact met huid, ogen en kleding. Adem geen dampen in. In geval van brand waternevel, schuim, droogpoeder of kooldioxide gebruiken. |
| VN-identificatienummers | UN2015 |
| HS-code | 2847.00.00 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen. Veroorzaakt ernstige brandwonden en oogletsel. Kan irritatie van de luchtwegen veroorzaken. Kan brand of explosie veroorzaken. |
Synthesemethoden voor waterstofperoxide
Waterstofperoxide kan op verschillende manieren worden gesynthetiseerd, waaronder het antrachinonproces, autooxidatie van 2-ethylantrahydrochinon en elektrolyse van verdund zwavelzuur . De meest gebruikelijke methode voor de commerciële productie van waterstofperoxide is het antrachinonproces.
Bij het antrachinonproces wordt antrachinon eerst gehydrogeneerd om antrahydrochinon te vormen, dat vervolgens in aanwezigheid van een katalysator met lucht wordt geoxideerd om waterstofperoxide te produceren. Vervolgens wordt het waterstofperoxide geëxtraheerd en gezuiverd met behulp van verschillende technieken, zoals destillatie en filtratie.
Een andere methode om waterstofperoxide te synthetiseren is de autooxidatie van 2-ethylantrahydrochinon. Bij deze methode wordt 2-ethylantrahydrochinon blootgesteld aan lucht in aanwezigheid van een alkalische katalysator, die autooxidatie van de verbinding bevordert om waterstofperoxide te produceren.
Elektrolyse van verdund zwavelzuur is een andere methode om waterstofperoxide te synthetiseren. Bij deze methode wordt verdund zwavelzuur geëlektrolyseerd met behulp van een speciale elektrolytische cel, die waterstofperoxide genereert aan een van de elektroden.
Waterstofperoxide kan ook op andere manieren worden gesynthetiseerd, zoals directe synthese uit waterstof en zuurstof of reductie van peroxiden met reductiemiddelen. Deze methoden worden echter niet vaak gebruikt voor de commerciële productie van waterstofperoxide vanwege hun lage efficiëntie en veiligheidsproblemen.
Gebruik van waterstofperoxide
Waterstofperoxide is een veelzijdige chemische verbinding met een breed scala aan toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van waterstofperoxide:
- De textiel-, papier- en pulpindustrie gebruikt H2O2 gewoonlijk als bleekmiddel om kleur uit stoffen en pulp te verwijderen.
- Zorginstellingen gebruiken H2O2 als een effectief ontsmettingsmiddel om bacteriën, virussen en schimmels te doden en om medische apparatuur en oppervlakken te steriliseren.
- Waterzuiveringsinstallaties gebruiken H2O2 om onzuiverheden zoals ijzer en mangaan te verwijderen en water te desinfecteren.
- Haarkleurmiddelen en producten voor het bleken van tanden gebruiken H2O2 om de kleur van haar en tanden lichter te maken.
- De lucht- en ruimtevaartindustrie gebruikt H2O2 als raketbrandstof.
- Bij de productie van verschillende polymeren, zoals polypropyleen, polyethyleen en polystyreen, wordt gebruik gemaakt van H2O2.
- H2O2 is een reinigingsmiddel dat nuttig is voor het verwijderen van vlekken en vuil van oppervlakken en voor het reinigen van contactlenzen.
- H2O2 wordt in de voedingsmiddelenindustrie gebruikt als bleekmiddel en conserveermiddel voor voedingsmiddelen.
Over het geheel genomen maakt de veelzijdigheid van H2O2 het tot een waardevolle chemische verbinding met vele toepassingen in verschillende industrieën.
Vragen:
Prijs waterstofperoxide
De prijs van waterstofperoxide kan sterk variëren, afhankelijk van verschillende factoren, zoals zuiverheid, concentratie en gekochte hoeveelheid. Over het algemeen kan de prijs van waterstofperoxide variëren van centen per pond voor waterstofperoxide van technische kwaliteit tot enkele dollars per pond voor zeer zuivere kwaliteiten die in speciale toepassingen worden gebruikt.
Vanaf februari 2023 bedroeg de gemiddelde prijs van 35% waterstofperoxide van voedingskwaliteit ongeveer $ 20 tot $ 30 per gallon of $ 0,10 tot $ 0,20 per vloeibare ounce. Waterstofperoxide van industriële kwaliteit met een lagere zuiverheid en concentratie kost mogelijk minder, meestal tussen de $ 1 en $ 5 per gallon. Prijzen kunnen echter variëren afhankelijk van aanbieder, regio en andere factoren.
Waar waterstofperoxide kopen?
Waterstofperoxide is een veel voorkomende chemische verbinding die bij verschillende leveranciers kan worden gekocht, zowel online als in fysieke winkels. Hier zijn enkele plaatsen waar u waterstofperoxide kunt kopen:
- Chemische leveranciers: Chemische leveranciers, zoals Sigma-Aldrich, Fisher Scientific en VWR International, bieden een breed scala aan kwaliteiten en concentraties waterstofperoxide voor verschillende toepassingen.
- Online marktplaatsen: Online marktplaatsen, zoals Amazon, eBay en Alibaba, bieden waterstofperoxide aan van verschillende leveranciers, met verschillende kwaliteiten en concentraties.
- Supermarkten en apotheken: Veel supermarkten en apotheken verkopen waterstofperoxide met een lage concentratie (3% tot 6%) als antisepticum voor wondreiniging en eerste hulp.
- Winkels voor zwembadbenodigdheden: Waterstofperoxide kan worden gebruikt als oxidatiemiddel voor zwembaden en spa’s om de helderheid van het water en desinfectie te behouden. Winkels voor zwembadbenodigdheden, zoals Leslie’s Pool Supplies, kunnen voor dit doel waterstofperoxideproducten vervoeren.
