Tolueen is een kleurloze vloeistof met een zoete, scherpe geur. Het wordt veel gebruikt als oplosmiddel, maar ook bij de productie van chemicaliën, kleurstoffen en farmaceutische producten. Het kan schadelijk zijn als het in grote hoeveelheden wordt ingenomen of ingeademd.
| IUPAC-naam | Methylbenzeen |
| Moleculaire formule | C7H8 |
| CAS-nummer | 108-88-3 |
| Synoniemen | Toluol, fenylmethaan, methylbenzeen, tolu-sol, tolueen, methylbenzeen, toluololie, aniseen, antisal 1A, benzeen, methyl, monomethylbenzeen |
| InChi | InChI=1S/C7H8/c1-7-5-3-2-4-6-7/h2-6H,1H3 |
Eigenschappen van tolueen
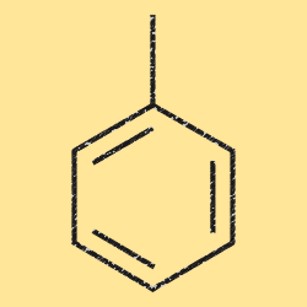
Structuur van tolueen
Tolueen heeft een eenvoudige chemische structuur, bestaande uit een benzeenring waaraan een enkele methylgroep is bevestigd. Het molecuul is vlak en heeft een gedelokaliseerde pi-elektronische binding. Deze unieke structuur maakt tolueen een nuttige grondstof bij de productie van verschillende chemicaliën, zoals benzeen en xyleen, maar ook bij de synthese van geneesmiddelen, kleurstoffen en polymeren.
Tolueen formule
De chemische formule voor tolueen is C7H8, wat het aantal en het type atomen weergeeft dat in het molecuul aanwezig is. Deze formule is belangrijk in verschillende industriële toepassingen omdat deze kan helpen bij het voorspellen van de fysische en chemische eigenschappen van de verbinding, zoals het smeltpunt, kookpunt en reactiviteit bij verschillende chemische reacties.
Dichtheid van tolueen g/ml
De dichtheid van tolueen is ongeveer 0,87 gram per milliliter bij standaardtemperatuur en druk. Deze relatief lage dichtheid is te wijten aan de lage molaire massa en de kleine moleculaire grootte van tolueen. De dichtheid van tolueen is belangrijk in veel industriële processen omdat deze de oplosbaarheid en reactiviteit van de verbinding bij verschillende chemische reacties kan beïnvloeden.
Molaire massa van tolueen
Tolueen, met de molecuulformule C7H8, heeft een molaire massa van ongeveer 92,14 gram per mol. Deze waarde kan worden verkregen door de atoommassa’s van de atomen waaruit het molecuul bestaat op te tellen. De relatief lage molmassa van tolueen maakt het tot een vluchtige en zeer mobiele verbinding, wat bijdraagt aan het gebruik ervan als oplosmiddel in verschillende industriële processen.
Kookpunt van tolueen
Tolueen heeft een kookpunt van ongeveer 110,6 graden Celsius bij standaard atmosferische druk. Dit relatief lage kookpunt maakt het gemakkelijk te verdampen en te gebruiken als oplosmiddel in een verscheidenheid aan industriële toepassingen, waaronder als verdunningsmiddel in verven en coatings, en bij de productie van synthetische vezels en rubber.
Smeltpunt van tolueen
Het smeltpunt van tolueen ligt rond de -95 graden Celsius. Dit maakt het een vloeistof bij standaardtemperatuur en -druk, maar kan gemakkelijk worden gestold door het tot onder het smeltpunt af te koelen. Het lage smeltpunt van tolueen is te wijten aan de zwakke intermoleculaire aantrekkingskrachten tussen de moleculen, die voornamelijk Van der Waals-krachten zijn.
Molecuulgewicht van tolueen
Het molecuulgewicht van tolueen is 92,14 gram per mol, berekend door de atoommassa’s van de atomen in het molecuul op te tellen. Deze waarde is belangrijk in verschillende industriële toepassingen omdat deze de fysische en chemische eigenschappen van de verbinding kan beïnvloeden, inclusief het kookpunt, het smeltpunt en de oplosbaarheid in verschillende oplosmiddelen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,866 |
| Kleur | Kleurloos |
| Geur | Zoet, kruidig |
| Molaire massa | 92,14 g/mol |
| Dikte | 0,87 g/ml bij 25°C |
| Fusie punt | -95°C |
| Kookpunt | 110,6°C |
| Flitspunt | 4,4°C |
| oplosbaarheid in water | 0,052 g/100 ml bij 25°C |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 22 mmHg bij 25°C |
| Dampdichtheid | 3,1 (lucht = 1) |
| pKa | 44 |
| pH | Niet toepasbaar |
Let op: Sommige waarden kunnen variëren afhankelijk van de bron en de meetomstandigheden.
Tolueenveiligheid en gevaren
Methylbenzeen kan bij onjuist gebruik verschillende veiligheidsrisico’s met zich meebrengen. Het is brandbaar en kan met lucht explosieve mengsels vormen. Houd het daarom uit de buurt van hitte, vonken en vlammen. Inademing van methylbenzeendamp kan irritatie van de luchtwegen, hoofdpijn, duizeligheid en slaperigheid veroorzaken, en chronische blootstelling kan leiden tot neurologische en gedragsveranderingen. Langdurig of herhaald contact met de huid kan dermatitis veroorzaken. Er is ook aangetoond dat methylbenzeen effecten heeft op de voortplanting en ontwikkeling van dieren en wordt geclassificeerd als kankerverwekkend uit categorie 2. Bij het hanteren van methylbenzeen moeten geschikte beschermende uitrusting en ventilatie worden gebruikt om de schade tot een minimum te beperken. blootstelling aan de gevaarlijke gevolgen ervan.
| Gevarensymbolen | Xn, F |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Gebruik explosieveilige elektrische/ventilatie/verlichtingsapparatuur. Houd de container goed gesloten. Adem geen dampen in. Draag handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. |
| VN-identificatienummers | VN 1294 |
| HS-code | 2902.2 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Methylbenzeen kan oog-, neus- en keelirritatie veroorzaken, evenals hoofdpijn, duizeligheid en slaperigheid. Chronische blootstelling kan leiden tot neurologische en gedragsveranderingen. Langdurig of herhaald contact met de huid kan uitdroging, gebarsten huid en dermatitis veroorzaken. Er is aangetoond dat methylbenzeen effecten heeft op de voortplanting en ontwikkeling van dieren. Het is door het International Agency for Research on Cancer (IARC) geclassificeerd als kankerverwekkend uit categorie 2. Bij het hanteren van methylbenzeen moeten geschikte beschermende uitrusting en ventilatie worden gebruikt om blootstelling te minimaliseren. |
Tolueensynthesemethoden
De chemische industrie produceert methylbenzeen doorgaans via een aantal synthesemethoden, waaronder katalytisch reformeren van nafta, katalytisch kraken van fracties van ruwe olie en disproportionering van methylbenzeen.
Katalytisch reformeren van nafta is een van de meest gebruikte methoden voor de productie van methylbenzeen, omdat hierdoor een mengsel van aromatische koolwaterstoffen ontstaat dat kan worden gescheiden en gezuiverd. Het proces omvat het laten reageren van nafta met een katalysator in aanwezigheid van waterstof, waardoor een mengsel van aromaten ontstaat, waaronder methylbenzeen.
Katalytisch kraken van ruwe oliefracties kan ook methylbenzeen produceren, evenals andere aromatische en niet-aromatische koolwaterstoffen. Dit proces omvat het laten reageren van fracties van ruwe olie met een hoog kookpunt met een katalysator bij hoge temperatuur en druk. Hierdoor worden moleculen afgebroken tot kleinere fragmenten die kunnen worden gescheiden en gezuiverd.
Disproportionering van methylbenzeen is een proces waarbij methylbenzeen wordt omgezet in een mengsel van benzeen en xylenen. De reactie wordt doorgaans uitgevoerd bij verhoogde temperatuur en druk in aanwezigheid van een katalysator en kan worden gebruikt om benzeen en xylenen met hoge zuiverheid te produceren voor gebruik in verschillende industriële toepassingen.
Gebruik van tolueen
Methylbenzeen heeft verschillende industriële en commerciële toepassingen vanwege zijn unieke eigenschappen als vluchtige, kleurloze vloeistof met een duidelijke geur. Enkele van de belangrijkste toepassingen zijn:
- Fabrikanten van oplosmiddelen gebruiken tolueen op grote schaal als oplosmiddel bij de vervaardiging van verven, coatings, lijmen en andere producten. Het wordt gewaardeerd vanwege zijn vermogen om een breed scala aan organische verbindingen op te lossen, evenals vanwege zijn relatief lage toxiciteit en hoge verdampingssnelheid.
- Tolueen verbetert de prestaties en efficiëntie van verbrandingsmotoren en wordt daarom gebruikt als component met een hoog octaangehalte in benzine.
- Fabrikanten gebruiken tolueen als een belangrijk tussenproduct bij de productie van verschillende chemicaliën, waaronder benzeen, xyleen en diverse andere aromatische verbindingen. Deze chemicaliën worden gebruikt bij de vervaardiging van kunststoffen, synthetische vezels, rubber en andere materialen.
- Sommige medische en farmaceutische toepassingen gebruiken tolueen, onder meer als bestanddeel van bepaalde plaatselijke medicijnen en als oplosmiddel voor bepaalde medische verbindingen.
- Onderzoekers gebruiken tolueen als oplosmiddel en reagens in verschillende laboratoriumonderzoekstoepassingen, vanwege het vermogen ervan om een breed scala aan organische verbindingen op te lossen en ermee te reageren.
Vragen:
Tolueen tot benzylalcohol
Een meerstapsproces volbrengt de omzetting van methylbenzeen in benzylalcohol. Een gemeenschappelijke aanpak omvat de volgende stappen:
- Oxidatie van methylbenzeen tot benzylchloride: Methylbenzeen kan worden geoxideerd tot benzylchloride met behulp van chloorgas en een katalysator zoals ijzer- of aluminiumchloride. Deze reactie omvat het vervangen van een waterstofatoom op de methylgroep van methylbenzeen door een chlooratoom.
- Hydrolyse van benzylchloride tot benzylalcohol: Benzylchloride kan worden gehydrolyseerd tot benzylalcohol met behulp van een waterige oplossing van natriumhydroxide. Deze reactie omvat het vervangen van de chloridegroep van benzylchloride door een hydroxylgroep.
- Zuivering van benzylalcohol: De resulterende benzylalcohol kan worden gezuiverd door destillatie of andere methoden om alle onzuiverheden te verwijderen.
Tolueen tot benzaldehyde
De omzetting van methylbenzeen in benzaldehyde kan worden bereikt via een meerstapsproces. Een gemeenschappelijke aanpak omvat de volgende stappen:
- Oxidatie van methylbenzeen tot benzylalcohol: Methylbenzeen kan worden geoxideerd tot benzylalcohol met behulp van een oxidatiemiddel zoals kaliumpermanganaat of chroomzuur. Deze reactie omvat het vervangen van een waterstofatoom op de methylgroep van methylbenzeen door een hydroxylgroep om benzylalcohol te vormen.
- Oxidatie van benzylalcohol tot benzaldehyde: Benzylalcohol kan verder worden geoxideerd tot benzaldehyde met behulp van een oxidatiemiddel zoals kaliumpermanganaat of natriumchloriet. Deze reactie omvat de verwijdering van de hydroxylgroep op de benzylalcohol om een carbonylgroep op het benzaldehyde te vormen.
- Zuivering van benzaldehyde: Het resulterende benzaldehyde kan worden gezuiverd door destillatie of andere methoden om alle onzuiverheden te verwijderen.
