Titaniumoxide, ook bekend als titaniumdioxide, is een natuurlijk wit pigment dat veel wordt gebruikt in verven, coatings, kunststoffen en zonnebrandmiddelen. Het heeft een hoge brekingsindex en opaciteit.
| IUPAC-naam | Titaan(IV)oxide |
| Moleculaire formule | TiO2 |
| CAS-nummer | 13463-67-7 |
| Synoniemen | Titaandioxide, titanium, anataas, brookiet, rutiel, octaëdrische moleculaire zeef (OMS), E171 |
| InChi | InChI=1S/2O.Ti |
| InChIKey=ZQIUJXQCIJLZJK-UHFFFAOYSA-N |
Eigenschappen van titaniumdioxide
Molaire massa van titaniumoxide
De molaire massa van titaniumoxide (TiO2) is ongeveer 79,87 g/mol. Het is een wit, geur- en smaakloos poeder, onoplosbaar in water en organische oplosmiddelen. De molaire massa wordt berekend door de atoommassa’s van één titaniumatoom en twee zuurstofatomen bij elkaar op te tellen, waaruit één TiO2-molecuul bestaat. Deze waarde is belangrijk voor het bepalen van de stoichiometrie van chemische reacties waarbij titaniumoxide betrokken is.
Kookpunt van titaniumoxide
Titaanoxide heeft geen goed gedefinieerd kookpunt, omdat het ontleedt voordat het zijn smeltpunt bereikt. De ontledingstemperatuur van TiO2 hangt af van de kristalstructuur, deeltjesgrootte en zuiverheid van het materiaal. Rutiel TiO2 ontleedt bijvoorbeeld bij ongeveer 1850°C, terwijl anataas TiO2 ontleedt bij een lagere temperatuur, rond 1600°C. Bij hogere temperaturen wordt titaniumoxide gereduceerd tot metallisch titanium. Deze eigenschap maakt het een bruikbaar materiaal bij toepassingen bij hoge temperaturen, zoals ovenbekledingen en vuurvaste stenen.
Smeltpunt van titaniumoxide
Het smeltpunt van titaniumoxide hangt af van de kristalstructuur. Anatase TiO2 heeft een smeltpunt van ongeveer 1550°C, terwijl rutiel TiO2 een hoger smeltpunt heeft van ongeveer 1850°C. Het smeltpunt van TiO2 wordt ook beïnvloed door onzuiverheden die in het materiaal aanwezig zijn, zoals ijzer en andere overgangsmetalen, die het smeltpunt kunnen verlagen en de kristalstructuur kunnen veranderen. Bij hoge temperaturen kan titaniumoxide worden gereduceerd tot titaniummetaal.
Dichtheid van titaniumoxide g/ml
De dichtheid van titaniumoxide hangt af van de kristalstructuur en deeltjesgrootte. Anatase TiO2 heeft een dichtheid van 3,78 g/cm3, terwijl rutiel TiO2 een hogere dichtheid heeft van 4,23 g/cm3. Onzuiverheden in het materiaal beïnvloeden de kristalstructuur van TiO2 en kunnen de pakkingsdichtheid van de deeltjes veranderen, waardoor de dichtheid ervan wordt beïnvloed. Vergeleken met andere metaaloxiden heeft titaniumoxide een lage dichtheid, waardoor het een bruikbaar materiaal is in toepassingen waarbij een lage gewicht-volumeverhouding gewenst is.
Molecuulgewicht van titaniumoxide
Het molecuulgewicht van titaniumoxide (TiO2) is ongeveer 79,87 g/mol. Het is een verbinding bestaande uit één titaniumatoom en twee zuurstofatomen. Het molecuulgewicht is belangrijk bij het bepalen van de stoichiometrie van chemische reacties waarbij titaniumoxide betrokken is, evenals bij de fysische en chemische eigenschappen ervan.
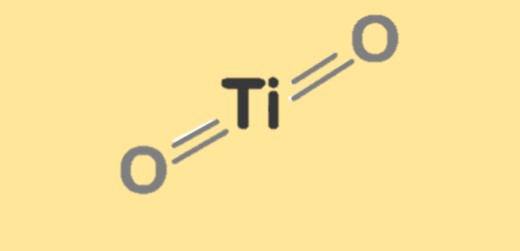
Structuur van titaniumdioxide
Titaandioxide heeft drie belangrijke kristalstructuren: rutiel, anataas en brookiet. Rutiel is het meest stabiel en heeft een tetragonale kristalstructuur, terwijl anataas een meer open en vervormde tetragonale structuur heeft. Brookiet heeft een orthorhombische kristalstructuur. De kristalstructuur van titaniumdioxide beïnvloedt de fysische en chemische eigenschappen ervan, zoals de dichtheid, het smeltpunt en de reactiviteit. De structuur van titaniumdioxide kan worden gewijzigd door dotering met andere metalen of door de syntheseomstandigheden te veranderen, wat resulteert in materialen met unieke eigenschappen en toepassingen.
Titaniumdioxide-formule
De chemische formule voor titaniumdioxide is TiO2, wat aangeeft dat elk TiO2-molecuul één titaniumatoom en twee zuurstofatomen bevat. De formule is belangrijk voor het bepalen van de stoichiometrie van chemische reacties waarbij titaniumdioxide betrokken is, evenals voor de fysische en chemische eigenschappen ervan. De formule kan ook worden gebruikt om de hoeveelheid titaniumdioxide te berekenen die nodig is voor een bepaalde toepassing, zoals bij de productie van pigmenten, coatings en keramiek.
| Verschijning | wit poeder |
| Soortelijk gewicht | 3,9 – 4,25 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 79,87 g/mol |
| Dikte | 3,78 – 4,23 g/cm3 |
| Fusie punt | 1550°C (anatase) – 1850°C (rutiel) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Onoplosbaar in water en organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | 6,5 – 8,5 |
Is titaandioxide veilig?
Titaandioxide wordt over het algemeen als veilig en niet-giftig beschouwd. Het is niet ontvlambaar, explosief of reactief met andere chemicaliën. Zoals elk fijn deeltje kan het echter bij inademing in hoge concentraties irriterend zijn voor de luchtwegen, wat kan leiden tot hoesten, een beklemmend gevoel op de borst en kortademigheid. Langdurige blootstelling aan hoge stofniveaus kan ook longschade veroorzaken. Het is belangrijk om titaandioxide in een goed geventileerde ruimte te hanteren en geschikte persoonlijke beschermingsmiddelen, zoals een stofmasker, te dragen bij het hanteren van grote hoeveelheden. Bovendien moet accidentele inname of oogcontact met titaniumdioxide worden vermeden.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Wordt onder normale gebruiksomstandigheden niet als gevaarlijk beschouwd |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 28230000 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Over het algemeen beschouwd als niet-giftig, maar kan bij inademing in hoge concentraties irriterend zijn voor de luchtwegen. |
Methoden voor het synthetiseren van titaniumoxide
Titaanoxide kan op verschillende manieren worden gesynthetiseerd, waaronder chemische en fysische processen. De meest voorkomende methoden zijn:
- Het sulfaatproces laat titaniumertsen reageren met zwavelzuur om een gehydrateerde vorm van titaniumdioxide te produceren, dat bij hoge temperaturen wordt gecalcineerd om het eindproduct te verkrijgen.
- Het chlorideproces omvat de reactie van titaniumertsen met chloorgas om titaniumtetrachloride te vormen, dat vervolgens hydrolyse ondergaat om titaniumdioxide te verkrijgen.
- Bij de sol-gel-methode wordt de hydrolyse van titaniumalkoxiden in oplossing gevolgd door een condensatiereactie die een gel vormt. Vervolgens wordt de gel gedroogd en gecalcineerd om titaniumoxide te produceren.
- Het vlamsyntheseproces produceert titaniumoxidedeeltjes door een brandstof en een oxidatiemiddel in een vlam te verbranden om een gasstroom met hoge temperatuur te genereren. De titaniumvoorloper wordt in de vlam geïnjecteerd, waar deze reageert en de deeltjes vormt.
- Bij de hydrothermische synthesemethode ondergaat een titaniumvoorloper oplossing in een waterige oplossing bij hoge temperatuur en hoge druk, wat de groei van titaniumoxidekristallen bevordert.
De keuze van de methode hangt af van de gewenste eigenschappen van het titaniumoxideproduct, evenals van de kosten en haalbaarheid van het proces. Elke methode heeft zijn eigen voordelen en beperkingen, en onderzoekers blijven nieuwe methoden onderzoeken voor het synthetiseren van titaniumoxide met verbeterde eigenschappen en prestaties.
Waar wordt titaandioxide voor gebruikt?
Titaanoxide heeft een breed scala aan toepassingen vanwege de unieke eigenschappen, waaronder de hoge brekingsindex, hoge opaciteit en uitstekende UV-bestendigheid. Enkele van de meest voorkomende toepassingen van titaniumoxide zijn:
- De pigmentindustrie maakt op grote schaal gebruik van titaniumdioxide in verven, coatings, kunststoffen en papier omdat het een hoge dekking, helderheid en UV-bestendigheid biedt, waardoor het een populaire keuze is voor buitentoepassingen.
- Fabrikanten gebruiken titaniumdioxide vaak in zonnebrandmiddelen en andere cosmetische producten als een effectief UV-absorberend middel om de huid tegen UV-stralen te beschermen.
- De productie van keramische materialen, waaronder elektrische keramiek, katalysatoren en keramische glazuren, is sterk afhankelijk van titaniumdioxide als sleutelcomponent.
- Bij verschillende chemische reacties, waaronder de productie van polyethyleen en andere polymeren, werkt titaniumdioxide als katalysator.
- De elektronica-industrie gebruikt titaniumdioxide bij de productie van elektronische apparaten, zoals condensatoren en weerstanden, vanwege de hoge diëlektrische constante en lage elektrische geleidbaarheid.
- Om hun reflectiviteit en duurzaamheid te verbeteren, brengen fabrikanten een dunne laag titaniumdioxide aan op lenzen, spiegels en andere optische componenten, die veel worden gebruikt in de optische coatingindustrie.
- Vanwege de uitstekende biocompatibiliteit en corrosieweerstand gebruiken medische implantaten, zoals tandheelkundige implantaten, titaniumdioxide in biomedische toepassingen.
De diversiteit aan toepassingen voor titaniumoxide onderstreept het belang ervan in verschillende industrieën en het potentieel ervan voor toekomstige innovaties.
Vragen: Titaandioxide in voedingsmiddelen
Titaandioxide is een voedingsadditief dat gewoonlijk wordt gebruikt om voedingsmiddelen witter en helderder te maken. Op het ingrediëntenlabel van voedingsproducten wordt het vaak vermeld als E171 of ’titaandioxide’. Het is goedgekeurd als kleurstof voor levensmiddelen in de Verenigde Staten, de Europese Unie en vele andere landen. Fabrikanten gebruiken het om een wit, glanzend uiterlijk te geven en om de textuur en consistentie van voedselproducten te verbeteren, waaronder snoep, kauwgom, gebak, zuivelproducten en dranken. Bovendien wordt het gebruikt als lichtverstrooiend middel om de opaciteit van bepaalde voedingsproducten te verbeteren.
Hoewel titaandioxide over het algemeen als veilig wordt beschouwd voor gebruik in voedsel, bestaat er bezorgdheid dat het consumeren ervan in grote hoeveelheden schadelijk kan zijn. Studies suggereren dat nanodeeltjes van titaniumdioxide toxische effecten kunnen hebben op de menselijke gezondheid, vooral op het spijsverteringsstelsel. Er is echter meer onderzoek nodig om de veiligheid van titaniumdioxide in voedingsmiddelen te bepalen.
Sommige landen hebben stappen ondernomen om het gebruik van titaniumdioxide in voedingsmiddelen te beperken. Frankrijk heeft bijvoorbeeld in 2020 het gebruik van titaniumdioxide als voedseladditief verboden, en de Europese Unie herziet momenteel de veiligheid van titaniumdioxide in voedsel. Consumenten moeten zich bewust zijn van de potentiële risico’s en voordelen van titaniumdioxide, zoals bij elk voedseladditief, en weloverwogen keuzes maken over het voedsel dat ze consumeren.
