Aluminiumsulfaat is een anorganisch zout dat gewoonlijk wordt gebruikt als coagulatiemiddel bij waterbehandelingsprocessen en als uitvlokmiddel bij vloeistofzuivering.
| IUPAC-naam | Aluminiumsulfaat |
| Moleculaire formule | Al2(SO4)3 |
| CAS-nummer | 10043-01-3 |
| Synoniemen | Aluminiumsulfaat, diaaluminiumsulfaat, cakealuin, papierfabriekaluin, filteraluin |
| InChi | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/h;;(H2,1,2,3,4)/q2+3;/p-3 |
Aluminiumsulfaatformule
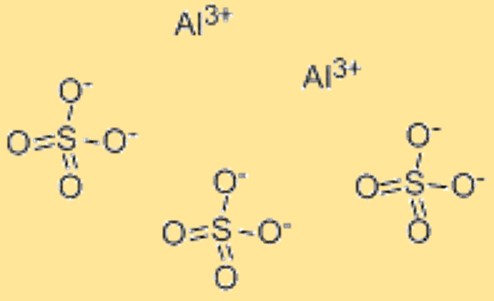
De chemische formule voor aluminiumsulfaat is Al2(SO4)3. Deze formule vertegenwoordigt de verhouding van atomen in aluminiumsulfaat en wordt gebruikt om de samenstelling van de verbinding aan te geven. De formule kan ook worden gebruikt bij chemische berekeningen, zoals het bepalen van de molaire massa of het aantal mol aluminiumsulfaat in een bepaald monster. De chemische formule voor aluminiumsulfaat biedt een handige manier om de samenstelling van het materiaal weer te geven en wordt algemeen erkend in de wetenschappelijke gemeenschap. Bovendien kan de formule worden gebruikt om de chemische en fysische eigenschappen van aluminiumsulfaat te voorspellen, zoals de oplosbaarheid ervan in water, de reactiviteit met andere verbindingen en de stabiliteit ervan onder verschillende omstandigheden.
Molaire massa van aluminiumsulfaat
De molaire massa van aluminiumsulfaat is 342,15 g/mol. Deze waarde is belangrijk bij verschillende chemische en fysische berekeningen, waaronder de bepaling van molaire concentraties, de stoichiometrie van reacties en de ideale gaswet. De molaire massa wordt berekend door de atoomgewichten van alle atomen in de chemische formule voor aluminiumsulfaat, namelijk Al2(SO4)3, bij elkaar op te tellen. Molaire massa kan ook worden gebruikt om de massa om te zetten in het aantal mol voor een bepaald monster aluminiumsulfaat.
Kookpunt van aluminiumsulfaat
Het kookpunt van aluminiumsulfaat is niet goed gedefinieerd omdat het ontleedt voordat het kookt. Aluminiumsulfaat is een gehydrateerd zout en verliest bij verhitting zijn hydratatiewater en valt uiteen in aluminiumoxide en zwavelzuur. De ontledingstemperatuur kan variëren van 120°C tot 140°C, afhankelijk van de mate van hydratatie. De aanwezigheid van onzuiverheden in het monster kan ook de ontledingstemperatuur beïnvloeden.
Smeltpunt van aluminiumsulfaat
Het smeltpunt van aluminiumsulfaat is ongeveer 1200°C. Deze hoge temperatuur is te wijten aan de sterke ionische bindingen tussen aluminium- en zwavelionen. Aluminiumsulfaat is bij kamertemperatuur een kristallijne vaste stof en heeft een goed gedefinieerde kristalstructuur, die bijdraagt aan het hoge smeltpunt. Het smeltpunt van aluminiumsulfaat is belangrijk bij het bepalen van de verwerkingsomstandigheden die nodig zijn voor de synthese en zuivering van het materiaal.
Dichtheid van aluminiumsulfaat g/ml
De dichtheid van aluminiumsulfaat is 1,8 tot 2,0 g/ml. Deze waarde kan variëren afhankelijk van de mate van hydratatie en de aanwezigheid van onzuiverheden in het monster. De dichtheid van aluminiumsulfaat is een belangrijke fysische eigenschap die kan worden gebruikt om het volume van een bepaalde massa van het materiaal te berekenen. De dichtheid van aluminiumsulfaat is ook nuttig bij het bepalen van de concentratie van een oplossing, omdat je hiermee de massa opgeloste stof per volume-eenheid oplosmiddel kunt berekenen.
Aluminiumsulfaat Moleculair gewicht
We bepalen dat het molecuulgewicht van aluminiumsulfaat 342,15 g/mol is door de atoomgewichten van alle atomen in de chemische formule Al2(SO4)3 bij elkaar op te tellen. Deze waarde dient als zowel molecuulgewicht als molaire massa en speelt een cruciale rol bij chemische berekeningen, waaronder het bepalen van molaire concentraties en reactiestoichiometrie.
Aluminiumsulfaatstructuur
Aluminiumsulfaat heeft een kristalstructuur die bestaat uit aluminiumkationen (Al3+) en sulfaatanionen (SO4^2-). De aluminiumkationen coördineren met zes sulfaatanionen in een strakke zeshoekige opstelling, bij elkaar gehouden door sterke ionische bindingen. De kristalstructuur van aluminiumsulfaat beïnvloedt de fysische eigenschappen ervan, zoals het smeltpunt en de oplosbaarheid.
| Verschijning | Kristallijne vaste stof |
| Soortelijk gewicht | 1,8 tot 2,0 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 342,15 g/mol |
| Dikte | 1,8 tot 2,0 g/ml |
| Fusie punt | 770°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet goed gedefinieerd |
| Dampdichtheid | Niet goed gedefinieerd |
| pKa | Niet goed gedefinieerd |
| pH | Neutrale |
Veiligheid en gevaren van aluminiumsulfaat
Aluminiumsulfaat is een gevaarlijke stof waarmee voorzichtig moet worden omgegaan. Inademing van het stof kan irritatie van de luchtwegen en hoesten veroorzaken. Contact met de huid of ogen kan roodheid, jeuk en een branderig gevoel veroorzaken. Het inslikken van aluminiumsulfaat kan gastro-intestinale irritatie veroorzaken, waaronder misselijkheid, braken en diarree. Als het in grote hoeveelheden wordt ingenomen, kan het tot ernstigere gezondheidsproblemen leiden, zoals depressie van het centrale zenuwstelsel en nierschade. Daarom is het belangrijk om persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, te dragen bij het hanteren van aluminiumsulfaat. Bovendien moet de werkruimte goed worden geventileerd om het risico op het inademen van stof te verminderen. In geval van contact met de huid of ogen moet het aangetaste gebied gedurende minimaal 15 minuten met veel water worden gespoeld en moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Xi – Irriterend |
| Beveiligingsbeschrijving | S24/25 – Vermijd contact met huid en ogen |
| AN-identificaties | UN3077 – Gevaar voor het milieu |
| HS-code | 2833.30.00 |
| Gevarenklasse | 8 – Bijtende stof |
| Verpakkingsgroep | III |
| Toxiciteit | Lage tot matige toxiciteit bij inslikken, inademen of contact met huid of ogen |
Synthesemethoden voor aluminiumsulfaat
Aluminiumsulfaat kan op verschillende manieren worden gesynthetiseerd, waaronder precipitatie en reactie met zwavelzuur.
Eén synthesemethode is de precipitatiemethode, waarbij een oplossing van aluminiumzouten met zwavelzuur wordt gemengd. Deze reactie resulteert in de vorming van aluminiumsulfaat, dat in vaste vorm uit de oplossing neerslaat. De vaste stof kan vervolgens worden gefilterd, gewassen en gedroogd om zuiver aluminiumsulfaat te verkrijgen.
Een andere synthesemethode is de reactiemethode, waarbij aluminiumhydroxide of aluminiumoxide wordt gemengd met zwavelzuur. Deze reactie resulteert in de vorming van aluminiumsulfaat en water. Het product kan vervolgens worden gezuiverd door wassen en drogen.
Bij beide methoden kan de zuiverheid van het eindproduct worden verbeterd door gebruik te maken van zeer zuivere uitgangsmaterialen en door de reactieomstandigheden zorgvuldig te controleren. De zuiverheid van aluminiumsulfaat kan worden gecontroleerd door de fysische en chemische eigenschappen ervan te analyseren, zoals de molmassa, het smeltpunt en de wateroplosbaarheid.
Over het geheel genomen is de synthese van aluminiumsulfaat een relatief eenvoudig proces dat kan worden uitgevoerd in het laboratorium of in een industriële omgeving, afhankelijk van de gewenste productieschaal. De keuze van de synthesemethode zal afhangen van de beschikbaarheid van grondstoffen, de gewenste zuiverheid van het product en de gewenste productieschaal.
Gebruik van aluminiumsulfaat
Industrieën gebruiken aluminiumsulfaat vanwege zijn veelzijdigheid in verschillende toepassingen, zoals waterbehandeling, papierproductie en landbouw. Bij de waterbehandeling werkt de stof als een stollingsmiddel en zuivert het drinkwater door ervoor te zorgen dat onzuiverheden zich ophopen en grotere deeltjes vormen die gemakkelijk kunnen worden gefilterd. De papierproductie-industrie gebruikt aluminiumsulfaat als vulmiddel en bindmiddel om de sterkte en glans van papier te verbeteren en de pH-waarde in de pulp te reguleren. In de landbouw verlaagt aluminiumsulfaat de pH van de bodem en verhoogt de zuurgraad, waardoor planten worden voorzien van essentiële voedingsstoffen zoals zwavel en aluminium. Aluminiumsulfaat heeft ook andere toepassingen, waaronder het looien van leer, het brandwerend maken van textiel en als vlokmiddel bij de behandeling van afvalwater. Aldus speelt aluminiumsulfaat een belangrijke rol in het moderne leven door verschillende doeleinden in verschillende industrieën te dienen.
Vragen:
Wat is de formule voor aluminiumsulfaat?
De chemische formule voor aluminiumsulfaat is Al2(SO4)3.
Is aluminiumsulfaat oplosbaar?
Ja, aluminiumsulfaat is in water oplosbaar. Het lost op in water en vormt een oplossing van aluminium-, sulfaat- en hydroxide-ionen. De oplosbaarheid van aluminiumsulfaat in water is temperatuurafhankelijk, wat betekent dat het beter oplosbaar is bij hogere temperaturen en minder oplosbaar bij lagere temperaturen. Bij kamertemperatuur is aluminiumsulfaat gemakkelijk oplosbaar in water, met een oplosbaarheid van ongeveer 20 gram per 100 milliliter water.
