4-Ethylfenol of C8H10O is een chemische verbinding met een zoete, kruidige en kruidachtige geur, gebruikt in parfums, smaakstoffen en als fungicide in de landbouw. Het kan ook een bijproduct zijn van wijnbederf.
| IUPAC-naam | 4-ethylfenol |
| Moleculaire formule | C8H10O |
| CAS-nummer | 104-96-7 |
| Synoniemen | p-ethylfenol, 4-hydroxyethylbenzeen, 4-EHP |
| InChi | InChI=1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5,9H.6H2.1H3 |
Formule 4-ethylfenol
De formule voor 4-ethylfenol is C8H10O. De formule geeft het aantal en de typen atomen in het molecuul weer en wordt gebruikt om de molaire massa, het molecuulgewicht en andere eigenschappen ervan te berekenen.
C8H10O NMR
Nucleaire magnetische resonantie (NMR) spectroscopie stelt wetenschappers in staat de structuur en samenstelling van moleculen te bestuderen. Door het C8H10O NMR-spectrum van 4-ethylfenol te analyseren, kunnen ze chemische verschuivingen, koppelingsconstanten en piekintensiteiten identificeren die informatie onthullen over de structuur en samenstelling van het molecuul.
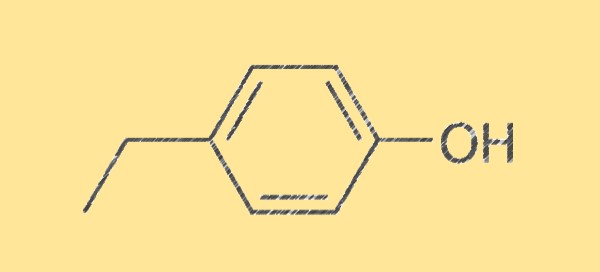
Structuur van 4-ethylfenol C8H10O
De structuur van 4-ethylfenol wordt gekenmerkt door zijn moleculaire formule, C8H10O, bestaande uit acht koolstofatomen, tien waterstofatomen en één zuurstofatoom. Het is een kleurloze vloeistof met een zoete, kruidige en kruidachtige geur. Het molecuul is symmetrisch en heeft een hydroxylgroep (-OH) gebonden aan een koolstofatoom, waardoor het een fenol is.
Molaire massa van 4-ethylfenol
De molaire massa van 4-ethylfenol is 134,17 g/mol. Molaire massa wordt gedefinieerd als de massa van een stof die één mol entiteiten bevat, zoals atomen, moleculen of ionen. Het wordt berekend door de atoommassa’s van alle elementen in het molecuul op te tellen. In het geval van 4-ethylfenol geeft de molecuulformule (C8H10O) ons de molaire massa van 134,17 g/mol.
Kookpunt van 4-ethylfenol
Het kookpunt van 4-ethylfenol is 218,7°C. Het kookpunt van een stof is de temperatuur waarbij de dampspanning gelijk is aan de atmosferische druk en de vloeistof in damp verandert. Het kookpunt van 4-ethylfenol is relatief hoog vanwege de intermoleculaire aantrekkingskrachten die in het molecuul aanwezig zijn.
Smeltpunt van 4-ethylfenol
Het smeltpunt van 4-ethylfenol is 9,7°C. Het smeltpunt van een stof is de temperatuur waarbij deze overgaat van vast naar vloeibaar. Het smeltpunt van 4-ethylfenol is relatief laag vanwege het lage molecuulgewicht en het ontbreken van sterke intermoleculaire krachten.
Dichtheid van 4-ethylfenol g/ml
De dichtheid van 4-ethylfenol is 1,02 g/ml. De dichtheid van een stof wordt gedefinieerd als de massa per volume-eenheid. Het wordt berekend door de massa van een stofmonster te delen door het volume. De dichtheid van 4-ethylfenol is relatief laag vanwege het lage molecuulgewicht en het ontbreken van sterke intermoleculaire krachten.
Molecuulgewicht van 4-ethylfenol
Het molecuulgewicht van 4-ethylfenol is 134,17 g/mol. Het molecuulgewicht is hetzelfde als de molaire massa en wordt berekend door de atoommassa’s van alle elementen in het molecuul op te tellen. In het geval van 4-ethylfenol geeft de molecuulformule (C8H10O) ons het molecuulgewicht van 134,17 g/mol.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,02 g/ml |
| Kleur | Kleurloos |
| Geur | Zoete, kruidige en kruidachtige geur |
| Molaire massa | 134,17 g/mol |
| Dikte | 1,02 g/ml |
| Fusie punt | 9,7°C |
| Kookpunt | 218,7°C |
| Flitspunt | 100°C |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 32 mmHg (20°C) |
| Dampdichtheid | 2,4 (lucht = 1) |
| pKa | 9.5 |
| pH | Neutrale |
Veiligheid en gevaren van 4-ethylfenol
Bewaar 4-ethylfenol uit de buurt van warmte- en ontstekingsbronnen, aangezien het een ontvlambare vloeistof is. Direct contact kan huid- en oogirritatie veroorzaken, en het inademen van de dampen of nevel kan irritatie van de luchtwegen veroorzaken. Bescherm uzelf door beschermende handschoenen, een veiligheidsbril en een gasmasker te dragen wanneer u met 4-ethylfenol werkt. Ga er voorzichtig mee om en voer het op de juiste wijze af in overeenstemming met de plaatselijke regelgeving.
| Gevarensymbolen | Ontvlambare vloeistof, irriterend |
| Beveiligingsbeschrijving | S2: Buiten bereik van kinderen houden; S24/25: Vermijd contact met huid en ogen; S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | UN 1993, Ontvlambare vloeistof, NOS (4-ethylfenol) |
| HS-code | 2909.30.90 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | III |
| Toxiciteit | Orale LD50 (rat) = 5.400 mg/kg. Kan huid- en oogirritatie veroorzaken. Inademing van de dampen of nevels kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van 4-ethylfenol
4-Ethylfenol wordt gesynthetiseerd door de reactie van fenol met ethyleenoxide in aanwezigheid van een alkalische katalysator, zoals natriumhydroxide of kaliumhydroxide. De reactie vindt plaats bij een temperatuur van 60-80°C en bij atmosferische druk. De molaire verhouding van fenol tot ethyleenoxide varieert van 1:1 tot 1:2, afhankelijk van de gewenste opbrengst en zuiverheid van 4-ethylfenol. Het reactiemengsel wordt vervolgens geneutraliseerd en gedestilleerd om het gewenste product te verkrijgen.
Een alternatieve synthesemethode omvat de reactie van 4-chloor-o-cresol met ethyleenoxide in aanwezigheid van een alkalische katalysator, zoals natriumhydroxide of kaliumhydroxide. De reactie vindt plaats bij een temperatuur van 60-80°C en bij atmosferische druk. De molaire verhouding van 4-chloor-o-cresol tot ethyleenoxide varieert van 1:1 tot 1:2, afhankelijk van de gewenste opbrengst en zuiverheid van het 4-ethylfenol. Het reactiemengsel wordt vervolgens geneutraliseerd en gedestilleerd om het gewenste product te verkrijgen.
Het is belangrijk op te merken dat beide methoden een zorgvuldige controle van temperatuur, druk en katalysatorconcentratie vereisen om de gewenste opbrengst en zuiverheid van 4-ethylfenol te bereiken. Het reactiemengsel moet ook zorgvuldig worden gecontroleerd op de aanwezigheid van onzuiverheden, zoals bijproducten van de reactie of verontreinigingen uit de grondstoffen, om de kwaliteit van het eindproduct te garanderen.
Gebruik van 4-ethylfenol
Industrieën gebruiken 4-ethylfenol op grote schaal als geuringrediënt in persoonlijke verzorgings- en huishoudelijke producten zoals parfums, zepen, wasmiddelen en kaarsen vanwege de zoete, kruidige, kruidige geur. De voedingsindustrie gebruikt 4-ethylfenol als smaakstof in snoep, gebak en alcoholische dranken. Als precursor produceert het ook andere verbindingen, zoals p-cresol, voor de farmaceutische en fijnchemische industrie.
Fabrikanten gebruiken 4-ethylfenol bij de productie van harsen, weekmakers en andere polymeren, maar ook bij de synthese van rubber en synthetische geurstoffen. Onderzoekers bestuderen ook het potentieel ervan als antischimmelmiddel vanwege de remmende effecten op de schimmelgroei.
Regelgevende instanties zoals de Europese Unie, de Amerikaanse Food and Drug Administration en de International Fragrance Association reguleren het gebruik van 4-ethylfenol om het veilige en verantwoorde gebruik ervan te garanderen. Het veilige gebruik van 4-ethylfenol vereist een zorgvuldige afweging van de mogelijke gevolgen voor de gezondheid en het milieu, evenals een juiste hantering en opslag.
Vragen:
Wat zijn ethylfenolen?
Ethylfenolen zijn een groep organische verbindingen die de functionele fenolgroep en een ethylgroep (-C2H5) bevatten die aan de fenolring is bevestigd. Ze worden geclassificeerd als aromatische alcoholen en hebben verschillende fysische en chemische eigenschappen, afhankelijk van de locatie van de ethylgroep op de fenolring. Veel voorkomende voorbeelden van ethylfenolen zijn 4-ethylfenol en 2-ethylfenol. Deze verbindingen hebben verschillende toepassingen in de parfum-, voedsel- en chemische industrie, maar ook bij de synthese van andere chemicaliën. Het gebruik van ethylfenolen is echter gereguleerd vanwege zorgen over hun mogelijke gevolgen voor de gezondheid en het milieu, en het veilige gebruik ervan vereist een zorgvuldige afweging van de vereisten voor hantering en opslag ervan.
Wat is de structuur van de verbinding die wordt beschreven door de onderstaande spectrale gegevens? formule c8h10o
Spectrale gegevens alleen kunnen de structuur van een verbinding niet definitief bepalen, maar kunnen wel informatie verschaffen om deze te identificeren. De formule C8H10O suggereert dat de verbinding een aromatische alcohol is, wat kan worden bevestigd door de aanwezigheid van een functionele alcoholgroep, aangegeven door een OH-piek in het IR-spectrum.
Het 1H NMR-spectrum zou informatie kunnen verschaffen over het aantal en het type waterstofatomen in het molecuul, zoals de aanwezigheid van aromatische waterstofatomen en alifatische waterstofatomen, evenals eventuele functionele groepen. Het 13C NMR-spectrum zou ook informatie kunnen verschaffen over het type koolstofatomen dat in het molecuul aanwezig is en over hun omgeving.
Op basis van deze informatie is het mogelijk om de structuur van de verbinding af te leiden, maar er zijn aanvullende informatie en analyse nodig om deze definitief te bevestigen. Enkele mogelijke structuren voor een verbinding met de formule C8H10O kunnen onder meer fenol, cresolen of xylenolen zijn.
Wat is volgens jou de structuur van het NMR-spectrum, weergegeven door de chemische formule c8h10o?
Je kunt de waarschijnlijke structuur van een molecuul met de chemische formule C8H10O als aromatische alcohol bepalen. Je zou een singlet- of doubletsignaal verwachten voor het hydroxylproton en verschillende pieken voor het aromatische protonsignaal in het 1H NMR-spectrum. In het 13C NMR-spectrum zie je signalen voor de koolstofatomen van de aromatische ring en de carbonylgroep.
Verschillende factoren, zoals omgeving, oplosmiddel en concentratie van het molecuul, evenals onzuiverheden of isomeren, kunnen de NMR-spectra beïnvloeden. Om de structuur van het molecuul definitief te bepalen, moet je het daadwerkelijke NMR-spectrum analyseren en interpreteren, hoewel je op basis van de chemische formule een voorspelling kunt doen.
Hoe bereken je de mate van onverzadiging van c8h10o?
De mate van onverzadiging van een molecuul kan worden berekend met behulp van de formule:
Mate van onverzadiging = (2 + aantal ringen) + (aantal dubbele bindingen / 2)
Het molecuul met formule C8H10O heeft slechts één ring omdat het een aromatische ring is. Het molecuul heeft geen dubbele bindingen omdat het een alcohol is en geen dubbele bindingen bevat.
Daarom zouden de onverzadigingsgraden voor C8H10O als volgt worden berekend:
Mate van onverzadiging = (2 + 1) + (0/2) = 3
Dit resultaat geeft aan dat het C8H10O-molecuul drie graden onverzadigdheid heeft en daarom waarschijnlijk een aromatische alcohol is. Het berekenen van de mate van onverzadiging biedt een snelle en gemakkelijke manier om de moleculaire structuur van een verbinding te schatten en te identificeren of deze onverzadigde functionele groepen of ringen bevat. Er moet echter worden opgemerkt dat deze methode enkele beperkingen heeft en niet voor alle verbindingen geschikt is.
Wat is c8h10o?
C8H10O is de chemische formule voor een molecuul dat 8 koolstofatomen, 10 waterstofatomen en 1 zuurstofatoom bevat. Het molecuul kan een van de vele verschillende chemische verbindingen zijn, waaronder aromatische alcoholen zoals onder meer fenol, cresolen of xylenolen.
Technieken zoals infraroodspectroscopie, nucleaire magnetische resonantiespectroscopie of massaspectrometrie bepalen de ware identiteit van het molecuul op basis van zijn moleculaire structuur en eigenschappen.
