Natriumhydroxide (NaOH) is een sterk alkalische stof die in de industrie veel wordt gebruikt als schoonmaakmiddel en bij de productie van zepen, wasmiddelen en papier. Het wordt ook wel loog of bijtende soda genoemd.
| IUPAC-naam | Natriumhydroxide |
| Moleculaire formule | NaOH |
| CAS-nummer | 1310-73-2 |
| Synoniemen | Bijtende soda, loog |
| InChi | InChI=1S/Na.H2O/h;1H2/q+1;/p-1 |
Eigenschappen van natriumhydroxide
Natriumhydroxide molaire massa
De molaire massa van natriumhydroxide is 40,00 g/mol. Het is de hoeveelheid massa van een stof die het aantal Avogadro-entiteiten bevat. De molmassa van NaOH is de som van de atoommassa’s van Na (22,9 g/mol), O (15,9 g/mol) en H (1 g/mol).
Natriumhydroxide-formule
De chemische formule voor natriumhydroxide is NaOH. Het bestaat uit een natriumion (Na+) en een hydroxide-ion (OH-). Natriumhydroxide is een sterke base en wordt in industriële toepassingen veel gebruikt als schoonmaakmiddel en bij de productie van zepen, wasmiddelen en papier.
Kookpunt van natriumhydroxide
Het kookpunt van NaOH is 1388°C (2530°F). Dit is de temperatuur waarbij de stof overgaat van vloeistof naar gas.
Smeltpunt van natriumhydroxide
Het smeltpunt van NaOH is 318°C (604°F). Dit is de temperatuur waarbij de stof overgaat van vaste naar vloeibare toestand.
Dichtheid van natriumhydroxide g/ml
De dichtheid van natronloog is 2,13 g/ml. Het is de maat voor de hoeveelheid massa in een volume-eenheid.
Natriumhydroxide Molecuulgewicht
Het molecuulgewicht van natronloog is 40,00 g/mol. Het is de som van de atoomgewichten van alle atomen van een molecuul van de stof.
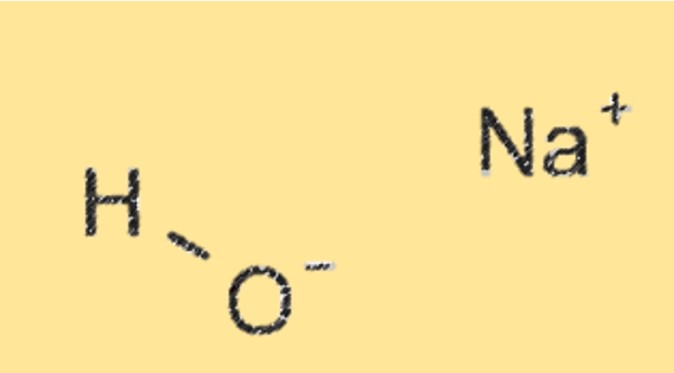
Structuur van natriumhydroxide
Natriumhydroxide is een witte kristallijne vaste stof die oplosbaar is in water. Het heeft een ionische structuur, waarbij natriumkationen (Na+) en hydroxideanionen (OH-) bij elkaar worden gehouden door ionische bindingen.
Concluderend is natronloog een witte kristallijne vaste stof met een molaire massa van 40,00 g/mol, een kookpunt van 1388 °C (2530 °F), een smeltpunt van 318 °C (604 °F) en een dichtheid van 2,13 g. / ml. en een molecuulgewicht van 40,00 g/mol. Het heeft een ionische structuur en de chemische formule is NaOH.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,13 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 40,00 g/mol |
| Dikte | 2,13 g/ml |
| Fusie punt | 318°C (604°F) |
| Kookpunt | 1388°C (2530°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol en glycerol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | – |
| pH (10% oplossing) | 13.0-13.8 |
Veiligheid en gevaren van natriumhydroxide
Natriumhydroxide is een sterk alkalische stof die zeer bijtend is en ernstige irritatie aan de huid en ogen kan veroorzaken. Inademing van de dampen kan ademhalingsproblemen veroorzaken. Het is ook zeer reactief met bepaalde metalen en produceert warmte en brandbaar waterstofgas. Er moet met zorg mee worden omgegaan en bij gebruik ervan moet geschikte beschermende uitrusting worden gebruikt. Bij contact met de huid of ogen onmiddellijk met water afspoelen en indien nodig een arts raadplegen.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | S26-S36/37/39 |
| VN-identificatienummers | VN1823 |
| HS-code | 2815.11.00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken, inademen en contact met de huid; irriterend voor de ogen, de huid en de luchtwegen |
Methoden voor de synthese van natriumhydroxide
NaOH kan op verschillende manieren worden gesynthetiseerd, waaronder het chlooralkaliproces, de elektrolyse van natriumchloride en de reactie van natriumcarbonaat met calciumhydroxide.
Het chlooralkaliproces produceert natronloog door elektrolyse van pekel (natriumchlorideoplossing). Elektrolyse vindt plaats in een membraancel of diafragmacel en resulteert in een waterige oplossing van NaOH.
Bij de reactie van natriumcarbonaat met calciumhydroxide wordt natriumcarbonaat toegevoegd aan een oplossing van calciumhydroxide, waardoor een neerslag van calciumcarbonaat en een oplossing van natronloog ontstaat. Om NaOH te verkrijgen kan calciumhydroxide ook aan een oplossing van natriumcarbonaat worden toegevoegd.
Gebruik van natriumhydroxide
Natriumhydroxide, ook bekend als loog of bijtende soda, is een veelzijdige chemische stof met veel industriële en huishoudelijke toepassingen.
De industrie maakt op grote schaal gebruik van natronloog bij de productie van zepen, wasmiddelen, textiel, papier en pulp. Ze gebruiken het ook als chemisch tussenproduct om andere chemicaliën te produceren, zoals natriumzouten, chloor en natriumchloraat.
Huishoudens gebruiken bijtende soda in schoonmaak- en afvoerreinigingsproducten zoals afvoerreinigers. De voedingsindustrie gebruikt het ook als pH-controlemiddel en als uitvloeimiddel bij het bakken.
Bovendien heeft natronloog toepassingen bij waterbehandeling en zuurneutralisatie. Het wordt gebruikt om de pH van het water aan te passen, leidingcorrosie onder controle te houden en het gehalte aan zware metalen in water te verminderen.
Vragen:
Wat is natriumhydroxide?
Natriumhydroxide (NaOH) is een sterk alkalische chemische verbinding. Het is een witte vaste stof met een zeer bijtende en gladde textuur. Het is oplosbaar in water en produceert een zeer basische oplossing. De industrie maakt op grote schaal gebruik van natronloog voor een verscheidenheid aan toepassingen, waaronder de productie van zeep en wasmiddelen, de productie van papier en textiel, pH-controle in de voedingsindustrie en waterbehandeling en neutralisatie. zuren. Ga voorzichtig om met bijtende soda, aangezien het gevaarlijk is en de huid en ogen ernstig kan irriteren en giftig kan zijn bij inslikken of inademen.
Is natriumhydroxide gebaseerd?
Ja, natronloog (NaOH) is een base. Het is een sterke base en wordt gewoonlijk bijtende soda genoemd. Natriumhydroxide heeft een hoge pH en kan zuren neutraliseren. De basiseigenschappen van natronloog zijn te wijten aan de aanwezigheid van hydroxide-ionen (OH-) in waterige oplossing. Wanneer bijtende soda wordt opgelost in water, dissocieert het in de samenstellende ionen, Na+ en OH-, wat resulteert in een zeer basische oplossing met een pH boven 7,0.
Is natriumhydroxide een sterke base?
Ja, natronloog (NaOH) is een sterke base. Het wordt als een sterke base beschouwd omdat het gemakkelijk dissocieert in water en hydroxide-ionen (OH-) produceert, die een sterke affiniteit hebben voor protonen (H+). Dit resulteert in een hoge concentratie hydroxide-ionen in de waterige oplossing, wat leidt tot een hoge pH en sterke basiciteit. Sterke basen, zoals bijtende soda, zijn in staat sterke zuren te neutraliseren en hebben in een waterige oplossing een pH groter dan 7,0. Bijtende soda wordt vaak gebruikt als pH-controlemiddel, neutralisatiemiddel en bij de vervaardiging van zepen, wasmiddelen, textiel en papierproducten.
Waar wordt natriumhydroxide voor gebruikt?
NaOH, ook wel bijtende soda of wassoda genoemd, wordt gebruikt voor een verscheidenheid aan industriële en huishoudelijke toepassingen. Enkele van de belangrijkste toepassingen van NaOH zijn:
- Productie van zeep en wasmiddelen: Bijtende soda wordt gebruikt als een belangrijk ingrediënt bij de productie van zepen, wasmiddelen en schoonmaakmiddelen.
- Waterbehandeling: Bijtende soda wordt gebruikt om de pH van het water aan te passen, leidingcorrosie onder controle te houden en het gehalte aan zware metalen in het water te verminderen.
- Textiel- en pulpproductie: Natronloog wordt gebruikt bij de productie van textiel, papier en pulp. Het wordt gebruikt om cellulosevezels zachter te maken en af te breken, zodat ze gemakkelijker te verwerken zijn.
- Chemische tussenproducten: Bijtende soda wordt gebruikt als chemisch tussenproduct bij de productie van andere chemicaliën, zoals natriumzouten, chloor en natriumchloraat.
- Voedingsindustrie: Bijtende soda wordt gebruikt als pH-controlemiddel en als afscheidingsmiddel bij het bakken. Het wordt ook gebruikt om de zuurgraad van fruit en groenten te reguleren.
- Reinigingsproducten: Bijtende soda wordt gebruikt in reinigings- en afvoerreinigingsproducten, zoals afvoerreinigers.
Wat is bijtende soda?
Bijtende soda is een andere naam voor NaOH, een witte, geurloze vaste stof met een sterk alkalische, gladde textuur. Het is een sterke base die gemakkelijk in water oplost en een zeer basische oplossing oplevert. Industrieën gebruiken op grote schaal bijtende soda in verschillende processen en toepassingen, zoals de productie van zepen, was- en reinigingsmiddelen, waterbehandeling en pH-controle in de voedingsmiddelenindustrie. De chemische stof speelt ook een cruciale rol bij de productie van papier en textiel en fungeert als chemisch tussenproduct bij de productie van andere chemicaliën.
Waar bijtende soda kopen?
Bijtende soda, ook bekend als natriumhydroxide, kan bij verschillende leveranciers worden gekocht, waaronder:
- Chemische distributeurs: Er zijn veel chemische distributeurs die gespecialiseerd zijn in de verkoop van industriële chemicaliën, waaronder natronloog. Enkele populaire chemische distributeurs zijn Spectrum Chemical, Fisher Scientific en VWR International.
- Online retailers: Online retailers zoals Amazon en eBay hebben een reeks chemicaliën, waaronder bijtende soda.
- Lokale bouwmarkten: Sommige lokale bouwmarkten hebben bijtende soda, meestal in kleine hoeveelheden, voor huishoudelijk gebruik.
- Industriële toeleveringsbedrijven: Industriële toeleveringsbedrijven zoals Grainger en MSC Industrial Direct bieden een breed scala aan industriële chemicaliën, waaronder natronloog, voor commercieel en industrieel gebruik.
Het is belangrijk om bijtende soda te kopen bij een gerenommeerde leverancier en ervoor te zorgen dat het product geschikt is voor het beoogde gebruik. Bovendien is het belangrijk om de aanbevelingen van de fabrikant voor opslag en hantering op te volgen, evenals alle relevante veiligheidsvoorschriften en richtlijnen, om een veilig en verantwoord gebruik van natronloog te garanderen.
