Natriumboorhydride (NaBH4) is een wit kristallijn poeder dat wordt gebruikt als reductiemiddel bij organische synthese en als waterstofbron voor brandstofcellen. Het is zeer reactief en gevoelig voor water.
| IUPAC-naam | Natriumtetrahydroboraat |
| Moleculaire formule | NaBH4 |
| CAS-nummer | 16940-66-2 |
| Synoniemen | Natriumboorhydride, natriumtetrahydridoboraat, natriumboorhydridehydraat, natriumtetrahydroboraathydraat |
| InChi | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
Eigenschappen van natriumboorhydride
Kookpunt van natriumboorhydride
Natriumboorhydride heeft geen duidelijk kookpunt, omdat het bij verhitting ontleedt. De ontledingstemperatuur is afhankelijk van de temperatuur- en drukomstandigheden.
Smeltpunt van natriumboorhydride
Natriumboorhydride heeft een smeltpunt van 240 tot 242°C. Bij deze temperatuur verandert de vaste vorm van NaBH4 naar de vloeibare toestand.
Dichtheid van natriumboorhydride g/ml
De dichtheid van natriumboorhydride is 1,33 g/ml. Het is een witte kristallijne vaste stof die relatief dicht is in vergelijking met andere stoffen.
Molaire massa van natriumboorhydride
De molaire massa van natriumboorhydride (NaBH4) is 37,83 g/mol. Het wordt berekend door de atoommassa’s van alle atomen op te tellen die aanwezig zijn in de molecuulformule van NaBH4 (1 natriumatoom, 1 booratoom en 4 waterstofatomen).
Molecuulgewicht van natriumboorhydride
Het molecuulgewicht van natriumboorhydride is 37,83 g/mol. Dit is de som van de atoommassa’s van de individuele atomen in de molecuulformule van NaBH4.
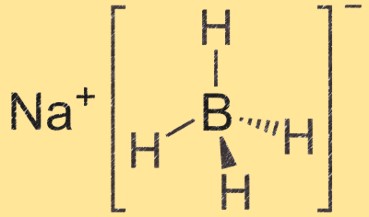
Structuur van natriumboorhydride
Natriumboorhydride is een tetraëdrische molecuul met een natriumion in het midden en daaraan vier boorhydridegroepen. Het booratoom is gebonden aan vier waterstofatomen, waardoor een tetraëdrische structuur ontstaat.
Natriumboorhydride-formule
De chemische formule voor natriumtetrahydroboraat is NaBH4. Het bestaat uit één natriumatoom (Na), één booratoom (B) en vier waterstofatomen (H). Deze formule vertegenwoordigt de chemische samenstelling van deze stof en de elementaire samenstelling ervan.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1,33 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 37,83 g/mol |
| Dikte | 1,33 g/ml |
| Fusie punt | 240-242°C |
| Kookpunt | Ontleedt bij verhitting |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van natriumboorhydride
Natriumtetrahydroboraat is brandbaar en reactief met water. Er kan brandbaar waterstofgas vrijkomen en met lucht explosieve mengsels ontstaan. Natriumtetrahydroboraat is ook irriterend voor de huid en de ogen. Er moeten adequate ventilatie en persoonlijke beschermingsmiddelen worden gebruikt om blootstelling te minimaliseren bij het hanteren van natriumtetrahydroboraat. Bewaar het op een koele, droge plaats, uit de buurt van ontstekingsbronnen en water.
| Gevarensymbolen | Ontvlambaar, irriterend |
| Beveiligingsbeschrijving | S26, S36/37 |
| VN-identificatienummers | UN3375 |
| HS-code | 2827.90.90 |
| Gevarenklasse | 4.3 |
| Verpakkingsgroep | II |
| Toxiciteit | Matig giftig bij inslikken, inademen en contact met de huid |
Methoden voor de synthese van natriumboorhydride
Natriumboorhydride (NaBH4) kan op verschillende manieren worden gesynthetiseerd, waaronder:
- Reductie van metallisch natrium: Deze methode omvat de reductie van boortrioxide (B2O3) met metallisch natrium om NaBH4 te produceren.
- Reductie van natriumhydride: Natriumhydride (NaH) kan worden gebruikt om boortrihalogeniden te verminderen om NaBH4 te produceren.
- Reductie van lithiumaluminiumhydride: Lithiumaluminiumhydride (LiAlH4) kan worden gebruikt om boorhalogeniden te verminderen om NaBH4 te produceren.
- Hydrogenering: Natriumboorhydride kan worden gesynthetiseerd door hydrogenering van natriumboorhydride (NaBH3H).
Gespecialiseerde apparatuur en opgeleid personeel in een goed geventileerde omgeving moeten al deze methoden uitvoeren, omdat natriumtetrahydroboraat ontvlambaar en reactief is. De gekozen synthesemethode zal afhangen van de gewenste opbrengst, zuiverheid en kostenoverwegingen.
Gebruik van natriumboorhydride
Natriumtetrahydroboraat (NaBH4) is een veelzijdig reductiemiddel en heeft een breed scala aan toepassingen op verschillende gebieden. Enkele veel voorkomende toepassingen van natriumtetrahydroboraat zijn:
- Organische synthese: NaBH4 wordt gebruikt bij de reductie van carbonylverbindingen, esters, nitrillen en amiden tot hun overeenkomstige alcoholen, aldehyden en aminen.
- Farmaceutische producten: Natriumtetrahydroboraat wordt gebruikt bij de synthese van verschillende actieve farmaceutische ingrediënten en bij de bereiding van chirale verbindingen.
- Polymer Science: NaBH4 wordt gebruikt bij de reductie van epoxyharsen en onverzadigde polyesterharsen.
- Milieu: Natriumtetrahydroboraat kan worden gebruikt bij de behandeling van afvalwater om verontreinigende stoffen zoals zware metalen en kleurstoffen te verminderen.
- Voedingsindustrie: NaBH4 wordt gebruikt als reductiemiddel bij de productie van magere smeersels, ijs en chocolade.
Over het geheel genomen heeft natriumtetrahydroboraat bewezen een waardevol hulpmiddel te zijn op het gebied van chemische synthese vanwege de milde reducerende eigenschappen ervan en het vermogen ervan om selectief functionele groepen in complexe moleculaire structuren te reduceren.
Vragen:
Welke van deze verbindingen kan worden gereduceerd met natriumboorhydride? vink alles aan wat van toepassing is.
Natriumtetrahydroboraat (NaBH4) kan een breed scala aan verbindingen verminderen, waaronder:
- Carbonylverbindingen, zoals aldehyden en ketonen
- Nitrilen
- Esters
- Amiden
- Epoxyharsen
- Onverzadigde polyesterharsen
- Bepaalde kleurstoffen
- Zware metalen
- Chirale verbindingen
Het is belangrijk op te merken dat specifieke omstandigheden en reactieparameters de reductie-efficiëntie en de selectiviteit van het reductieproces kunnen beïnvloeden. Bovendien zijn niet alle verbindingen geschikt voor reductie met natriumtetrahydroboraat, omdat sommige ongewenste nevenreacties kunnen ondergaan.
Waarom is het belangrijk om natriumboorhydride bloot te stellen aan vocht?
Blootstelling van natriumtetrahydroboraat (NaBH4) aan vocht is om verschillende redenen belangrijk:
- Reactiviteit: Natriumtetrahydroboraat is zeer reactief en kan snel ontleden in aanwezigheid van vocht, waarbij waterstofgas en warmte ontstaan. Als er niet op de juiste manier mee wordt omgegaan, kan dit een risico op explosie en brand met zich meebrengen.
- Hydrolyse: Natriumtetrahydroboraat hydrolyseert gemakkelijk in aanwezigheid van vocht om natriumtetrahydroboraathydraat (NaBH4.xH2O) te vormen, dat verminderde reducerende eigenschappen heeft vergeleken met de watervrije vorm.
- Opslagstabiliteit: Vocht kan ervoor zorgen dat natriumtetrahydroboraat geleidelijk ontbindt, waardoor de houdbaarheid en effectiviteit als reductiemiddel worden verminderd.
Daarom is het belangrijk om natriumboorhydride in een droge, luchtdichte verpakking op te slaan en in een goed geventileerde omgeving te hanteren om blootstelling aan vocht tot een minimum te beperken. Als blootstelling aan vocht onvermijdelijk is, kan het gebruik van vochtverwijderende middelen of beschermende atmosferen de effecten ervan op de stabiliteit en reactiviteit van natriumtetrahydroboraat helpen minimaliseren.
Is natriumboorhydride een katalysator?
Natriumtetrahydroboraat (NaBH4) wordt over het algemeen niet als katalysator beschouwd, maar eerder als reductiemiddel. Een katalysator is een stof die een chemische reactie versnelt zonder zelf permanente verandering te ondergaan. Natriumtetrahydroboraat verandert chemisch naarmate het wordt gereduceerd en wordt verbruikt tijdens de reductiereactie.
Bij organische synthese- en reductiereacties wordt gewoonlijk natriumtetrahydroboraat gebruikt als bron van hydride (H-) ionen. Natriumtetrahydroboraat brengt deze hydride-ionen over naar het substraatmolecuul, waardoor functionele groepen zoals carbonylen, nitrillen en esters worden gereduceerd. Ondanks zijn rol als reductiemiddel kan natriumtetrahydroboraat een secundaire rol spelen als protonacceptor, waardoor het een milde base wordt die de reactieomstandigheden kan beïnvloeden en het reactieresultaat kan beïnvloeden.
Welk brandbaar gas ontstaat als natriumboorhydride met water wordt gemengd?
Als natriumtetrahydroboraat (NaBH4) wordt gemengd met water, ondergaat het een snelle hydrolyse om gehydrateerd natriumboorhydride (NaBH4.xH2O) en waterstofgas te vormen. Het geproduceerde waterstofgas is brandbaar en kan bij onjuist gebruik explosie- en brandgevaar opleveren.
De reactie tussen natriumtetrahydroboraat en water kan exotherm zijn en warmte genereren, wat de hydrolysesnelheid verder kan versnellen en de afgifte van waterstofgas kan verhogen. De reactie kan ook in korte tijd een grote hoeveelheid gas genereren, waardoor er risico op overdruk en explosie ontstaat.
Daarom is het belangrijk om natriumtetrahydroboraat in een goed geventileerde omgeving te hanteren en blootstelling aan vocht of water te vermijden. Als blootstelling aan vocht onvermijdelijk is, kan het gebruik van vochtverwijderende middelen of beschermende atmosferen helpen de hydrolysesnelheid en het vrijkomen van waterstofgas te minimaliseren.
Hoeveel mol kamfer reageert met natriumboorhydride?
Het aantal mol kamfer dat zal reageren met natriumtetrahydroboraat (NaBH4) hangt af van verschillende factoren, waaronder de stoichiometrie van de reactie, de concentratie en zuiverheid van de reactanten, en de reactieomstandigheden. De stoichiometrie van de reactie kan worden bepaald uit de chemische vergelijking voor de reductie van kamfer tot isoborneol met behulp van natriumtetrahydroboraat:
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
Volgens de vergelijking reageert één mol kamfer met 4 mol natriumtetrahydroboraat. De werkelijke hoeveelheid kamfer die zal reageren met een gegeven hoeveelheid NaBH4 zal afhangen van de concentratie en zuiverheid van de reactanten, evenals van reactieomstandigheden zoals temperatuur, tijd en katalysator.
Daarom is het zonder nauwkeurigere informatie niet mogelijk om het exacte aantal mol kamfer te bepalen dat zal reageren met natriumtetrahydroboraat.
