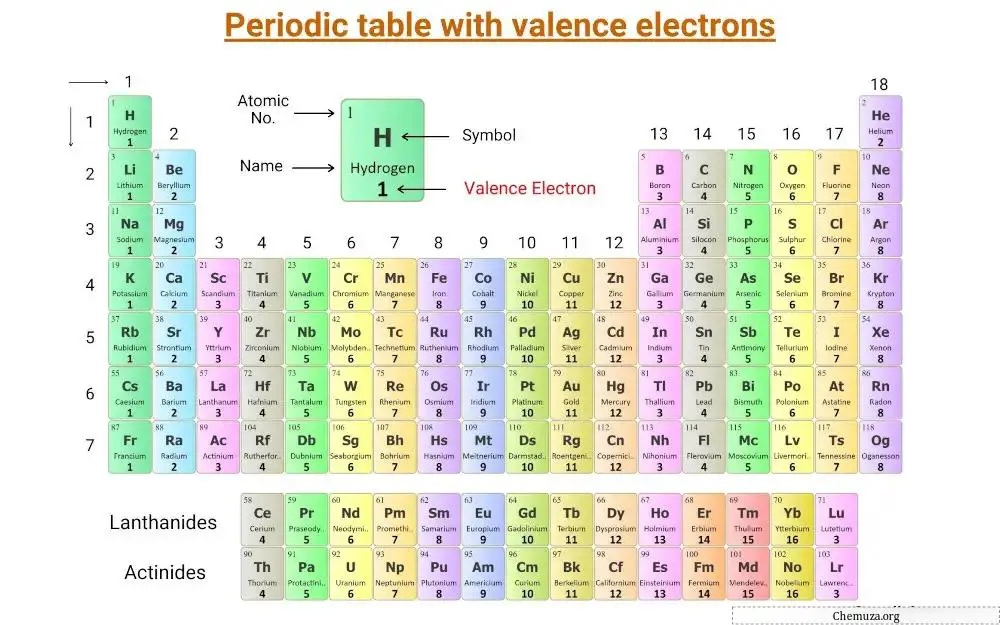
Dit is een periodiek systeem waarop valentie-elektronen zijn gelabeld.
Laten we het concept van valentie-elektronen begrijpen, samen met het aantal valentie-elektronen van hoofdgroepelementen en overgangselementen .
Wat zijn valentie-elektronen?
Valentie-elektronen zijn de elektronen die zich in de buitenste schil of het energieniveau van een atoom bevinden en die betrokken zijn bij chemische binding.
Magnesium heeft bijvoorbeeld 2 elektronen in zijn buitenste baan , dus het heeft 2 valentie-elektronen. [1]
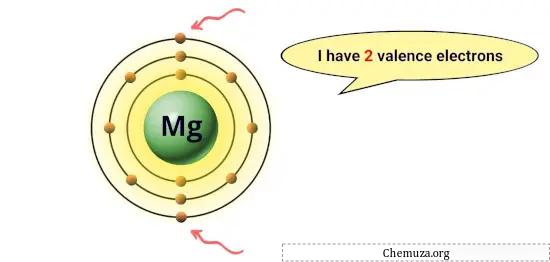
Deze elektronen zijn verantwoordelijk voor de chemische eigenschappen van een element, zoals de reactiviteit ervan en de soorten chemische bindingen die het met andere atomen kan vormen.
Het aantal valentie-elektronen dat een atoom heeft, bepaalt zijn positie in het periodiek systeem en zijn vermogen om chemische bindingen te vormen.
Valentie-elektronen van hoofdgroepelementen
De belangrijkste groepselementen, ook wel representatieve elementen genoemd, bevinden zich in de groepen 1, 2 en 13 tot en met 18 van het periodiek systeem.
Het aantal valentie-elektronen in deze elementen is gelijk aan hun groepsnummer.
Elementen uit Groep 1, zoals lithium en natrium , hebben bijvoorbeeld één valentie-elektron, terwijl elementen uit Groep 2, zoals magnesium en calcium , twee valentie-elektronen hebben.
Groep 13-elementen, zoals boor en aluminium , hebben drie valentie-elektronen, enzovoort.
Deze valentie-elektronen zijn verantwoordelijk voor de unieke chemische eigenschappen en reactiviteit van de elementen.
Valentie-elektronen van overgangs- en interne overgangselementen
De valentie-elektronen van overgangselementen en interne overgangselementen zijn ingewikkelder te bepalen dan die van hoofdgroepelementen.
De sublaag d van de overgangselementen en de sublaag f van de interne overgangselementen zijn inderdaad onvolledig gevuld en liggen zeer dicht bij de externe sublaag s.
Als gevolg hiervan kunnen de elektronen van de d- en s-subschillen in de overgangselementen en van de f- en s-subschillen in de interne overgangselementen zich gedragen als valentie-elektronen.
Voor overgangselementen kunnen de valentie-elektronen variëren van 3 tot 12 vanwege de bijdrage van d-subshell- en s-subshell-elektronen. In sommige gevallen worden elektronen in onvolledige d-orbitalen ook als valentie-elektronen beschouwd. [2]
Op dezelfde manier kunnen voor interne overgangselementen (of f-blokelementen) de valentie-elektronen variëren van 3 tot 16 vanwege de bijdrage van f-subshell- en s-subshell-elektronen. [3] Elektronen in onvolledige d-orbitalen kunnen in sommige interne overgangsmetalen ook worden beschouwd als valentie-elektronen.
Het is belangrijk op te merken dat voor overgangs- en interne overgangselementen de valentie-elektronen de elektronen zijn die aanwezig zijn in de schillen buiten de edelgaskern.
