Natriumcarbonaat of natriumcarbonaat is een anorganische verbinding met de chemische formule Na2CO3. Het is een alkalisch zout, wit van kleur en oplosbaar in water. Het wordt gebruikt in veel industriële en commerciële processen, zoals bij de vervaardiging van glas, papier, zepen, was- en schoonmaakmiddelen.
| IUPAC-naam | Natriumcarbonaat |
| Moleculaire formule | Na2CO3 |
| CAS-nummer | 497-19-8 |
| Synoniemen | Watervrij Na2CO3, gedecahydrateerd Na2CO3, wassoda, natriumcarbonaat |
| InChi | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Eigenschappen van natriumcarbonaat
Natriumcarbonaat molaire massa
De molaire massa van natriumcarbonaat is 106,0 g/mol. Het is de som van de atoommassa’s van alle atomen in een natriumcarbonaatmolecuul. Molaire massa is een belangrijke fysische eigenschap die in veel berekeningen in de scheikunde en andere wetenschappen wordt gebruikt.
Kookpunt van natriumcarbonaat
Natriumcarbonaat heeft een kookpunt van 1600°C. Dit is de temperatuur waarbij de dampdruk van de vloeistof gelijk is aan de druk van de omringende atmosfeer en de vloeistof kookt. Kookpunt is een nuttige eigenschap voor het identificeren en scheiden van verschillende verbindingen.
Smeltpunt van natriumcarbonaat
Na2CO3 heeft een smeltpunt van 851°C. Dit is de temperatuur waarbij de vaste vorm van de verbinding in een vloeistof verandert. Smeltpunt is een belangrijke eigenschap die wordt gebruikt bij de identificatie en zuivering van verschillende stoffen.
Dichtheid van natriumcarbonaat g/ml
Na2CO3 heeft een dichtheid van 2,54 g/ml. Dichtheid wordt gedefinieerd als de massa per volume-eenheid van een stof en is een nuttige eigenschap voor het bepalen van de concentratie van een oplossing.
Natriumcarbonaat Molecuulgewicht
Het molecuulgewicht van natriumcarbonaat is 106 g/mol. Het is de som van de atoomgewichten van alle atomen in een molecuul. Molecuulgewicht is een belangrijke eigenschap die wordt gebruikt in veel berekeningen in de scheikunde en andere wetenschappen.
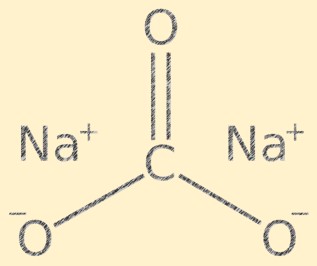
Structuur van natriumcarbonaat
Na2CO3 heeft een kristalstructuur en is samengesteld uit natriumkationen (Na+) en carbonaatanionen (CO3-). Het carbonaation heeft een trigonale vlakke vorm, met het koolstofatoom in het midden en de zuurstofatomen eraan vastgemaakt in een hoek van 120 graden. De natriumionen en carbonaationen worden bij elkaar gehouden door ionische bindingen, waardoor de verbinding zijn karakteristieke kristalstructuur krijgt.
| Verschijning | Wit kristallijn poeder of kleine witte kristallen |
| Soortelijk gewicht | 2,54 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 106,0 g/mol |
| Dikte | 2,54 g/ml |
| Fusie punt | 851°C |
| Kookpunt | 1600°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in glycerol, enigszins oplosbaar in ethanol |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | 10.3 |
| pH | 11.6 (1M-oplossing) |
Veiligheid en gevaren van natriumcarbonaat
Natriumcarbonaat is een basische verbinding en kan huid- en oogirritatie veroorzaken. Inademing van het stof kan irritatie van de luchtwegen veroorzaken. Het is ook schadelijk bij inslikken en kan spijsverteringsproblemen veroorzaken. Hantering moet plaatsvinden met handschoenen en een veiligheidsbril, en de stof moet op een koele, droge plaats worden bewaard, uit de buurt van ontstekingsbronnen. Vermijd het innemen of inhaleren van het poeder en was het grondig na gebruik.
| Gevarensymbolen | XI, N |
| Beveiligingsbeschrijving | Irriterend |
| VN-identificatienummers | Een 1824 |
| HS-code | 2836.90.90 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Orale LD50 (rat) = 915 mg/kg. Inhalatie LC50 (rat) = >10 mg/l/4u. Kan bij inademing huid- en oogirritatie en irritatie van de luchtwegen veroorzaken. Kan schadelijk zijn bij inslikken. |
Methoden voor de synthese van natriumcarbonaat
Natriumcarbonaat kan op twee manieren worden gesynthetiseerd: het Solvay-proces en de precipitatiemethode. Het Solvay-proces, ook bekend als het ammoniak-sodaproces, omvat de reactie van natriumchloride, ammoniak en kooldioxide om natriumcarbonaat, ammoniumchloride en water te produceren. De precipitatiemethode omvat de reactie van natriumhydroxide en koolstofdioxide om natriumcarbonaat en water te produceren. Beide methoden resulteren in een product met een hoge zuiverheid dat kan worden gebruikt voor verschillende toepassingen, zoals waterbehandeling, productie van zeep en wasmiddelen en glasproductie. Het Solvay-proces is de meest gebruikte methode vanwege de lagere productiekosten en het hogere productierendement.
Gebruik van natriumcarbonaat
Industrieën gebruiken natriumcarbonaat of wassoda voor verschillende doeleinden. De wasmiddelenindustrie gebruikt het als waterontharder en pH-regelaar, de glasindustrie gebruikt het om vlakglas, verpakkingsglas en speciaal glas te maken, en de papierindustrie gebruikt het om zure afvalstromen te neutraliseren en de pH aan te passen. In de chemische industrie is natriumcarbonaat een belangrijk ingrediënt bij de productie van natriumsilicaten en bicarbonaten. Het dient ook als voedseladditief en reinigingsmiddel in ketels en waterbehandelingsprocessen in de voedingsmiddelenindustrie. Bovendien speelt natriumcarbonaat een rol bij de productie van kleurstoffen, email, keramiek en fungeert het als brandblusser in brandblussers.
