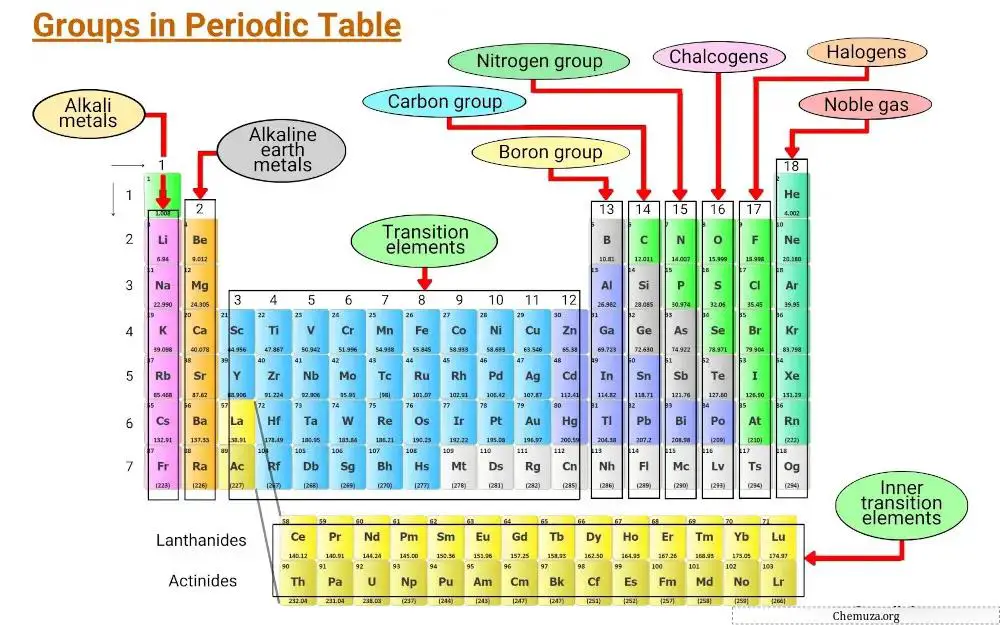
Elementen zijn gegroepeerd op basis van gemeenschappelijke kenmerken, waaronder elektronische configuraties en het gedrag van valentie-elektronen.
De verticale kolommen van het periodiek systeem worden groepen genoemd, en er zijn 18 groepen in het periodiek systeem, elk met zijn eigen reeks eigenschappen die bepalen hoe een element zal interageren met andere elementen en verbindingen zal vormen.
In dit artikel zullen we de verschillende groepen in het periodiek systeem verkennen.
Laten we er meteen mee beginnen!.
Groep 1: Alkalimetalen
Groep 1 van het periodiek systeem staat bekend als de alkalimetalen .
Deze groep omvat lithium, natrium, kalium, rubidium, cesium en francium.
Alkalimetalen staan bekend om hun zachtheid, laag smeltpunt en hoge reactiviteit met water en lucht.
Alkalimetalen zijn zeer reactief omdat ze slechts één elektron in hun buitenste schil hebben, dat ze gemakkelijk opgeven om positieve ionen te vormen. [1]
Dit maakt ze uitstekende elektriciteitsgeleiders en bruikbaar in veel toepassingen, waaronder batterijen en industriële processen.
Vanwege hun hoge reactiviteit moeten alkalimetalen echter met zorg worden gehanteerd. Ze kunnen spontaan ontbranden in de lucht en explosief reageren met water, waarbij waterstofgas vrijkomt. [2]
Groep 2: Aardalkalimetalen
Groep 2 van het periodiek systeem staat bekend als de ‘ aardalkalimetalen ‘. Deze groep omvat zes elementen: beryllium, magnesium, calcium, strontium, barium en radium.
Deze metalen worden “alkalisch” genoemd omdat ze met water reageren en alkalische (basische) oplossingen vormen.
Aardalkalimetalen hebben vergelijkbare eigenschappen, waaronder hoge smelt- en kookpunten, lage dichtheden en het vermogen om gemakkelijk ionen te vormen met een lading van +2.
Ze zijn ook zeer reactief, vooral met water en zuurstof. In tegenstelling tot alkalimetalen uit groep 1 zijn ze echter minder reactief en hebben ze een hoger smeltpunt.
Deze elementen zijn te vinden in veel alledaagse voorwerpen, waaronder botten (calcium), vuurwerk (strontium) en vliegtuigonderdelen (magnesium).
Aardalkalimetalen worden ook gebruikt in industriële processen, zoals de productie van aluminium en staal.
Groep 3 – 11: Overgangsmetalen
Groep 3 tot 11 van het periodiek systeem staat bekend als de overgangsmetaalgroep . Deze metalen hebben unieke kenmerken waardoor ze zich onderscheiden van andere items op tafel.
Een van de bepalende kenmerken van overgangsmetalen is hun vermogen om gekleurde verbindingen te vormen.
Dit komt door hun unieke elektronische configuraties, waardoor ze bepaalde golflengten van licht kunnen absorberen en reflecteren. [3]
Overgangsmetalen staan ook bekend om hun hoge smelt- en kookpunten, evenals hun sterkte en duurzaamheid.
Ze worden vaak gebruikt in bouwmaterialen, elektrische bedrading en zelfs sieraden.
Groep 13: boorgroep
Groep 13 van het periodiek systeem staat bekend als de boorgroep en omvat de elementen boor (B), aluminium (Al), gallium (Ga), indium (In), thallium (Tl) en nihonium (Nh).
Deze elementen delen bepaalde kenmerken waardoor ze chemisch vergelijkbaar zijn.
Borium is het enigemetalloïde in deze groep, wat betekent dat het zowel metalen als niet-metalen eigenschappen heeft.
Groep 14: Koolstofgroep
Groep 14 van het periodiek systeem staat bekend als de Koolstofgroep en omvat Koolstof (C), Silicium (Si), Germanium (Ge), Tin (Sn), Lood (Pb) en Flerovium (Fl).
Deze elementen hebben vergelijkbare eigenschappen omdat ze allemaal vier valentie-elektronen hebben.
Koolstof is een heel belangrijk element omdat het de basis vormt van alle organische moleculen, inclusief de bouwstenen van het leven zoals eiwitten en DNA. [4]
Groep 15: Pnictogenen
Groep 15 van het periodiek systeem is ook bekend als de stikstofgroep (of pnictogenen).
Deze groep bevat 6 elementen: stikstof (N), fosfor (P), arseen (As), antimoon (Sb), bismut (Bi) en moscovium (Mc).
Groep 15-elementen hebben vijf valentie-elektronen in hun buitenste elektronenschil, wat betekent dat ze de neiging hebben om drie covalente bindingen te vormen om hun octet te voltooien.
Ze hebben ook de neiging om drie elektronen te verkrijgen om anionen te vormen. Elementen worden minder niet-metaalachtig en meer metaalachtig in de groep.
Groep 16: Chalcogenen
Groep 16 van het periodiek systeem staat bekend als de zuurstofgroep. Het omvat de elementen zuurstof (O), zwavel (S), selenium (Se), telluur (Te), polonium (Po) en hepatisch (Lv).
Deze elementen delen bepaalde kenmerken, waaronder het hebben van zes valentie-elektronen in hun buitenste energieniveau.
Zuurstof is het meest voorkomende element van deze groep en is essentieel voor het leven, omdat het een sleutelbestanddeel is van water en veel organische moleculen.
Elementen in de zuurstofgroep kunnen verbindingen vormen met veel andere elementen, waaronder metalen en niet-metalen .
Groep 17: Halogenen
Groep 17 van het periodiek systeem is ook bekend als de halogeengroep . Het is samengesteld uit zes elementen: fluor, chloor, broom, jodium, astatine en tennessine.
Alle halogenen hebben zeven elektronen in hun buitenste schil, ook wel de valentieschil genoemd. Dit maakt ze zeer reactief, omdat ze slechts één extra elektron nodig hebben om hun buitenste schil te voltooien en stabiel te worden.
Een ander belangrijk kenmerk van halogenen is dat het allemaal niet-metalen zijn, wat betekent dat ze geen elektriciteit geleiden en niet kneedbaar of ductiel zijn zoals metalen.
Ze bestaan ook in alle drie de toestanden van de materie bij kamertemperatuur, waarbij fluor en chloor gassen zijn, broom een vloeistof is en jodium en astatine vaste stoffen zijn.
Groep 18: Zeldzame gassen
Groep 18 van het periodiek systeem wordt ook wel de edelgassen genoemd.
Edelgassen zijn onder meer helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) en radon (Rn).
Deze gassen worden edel genoemd omdat ze zeer stabiel zijn en niet gemakkelijk reageren met andere elementen.
Edelgassen bevinden zich in de meest rechtse kolom van het periodiek systeem en hebben allemaal een volledige buitenste schil van elektronen, waardoor ze zeer onreactief zijn.
Ze zijn ook geurloos, kleurloos en hebben lage kook- en smeltpunten.
