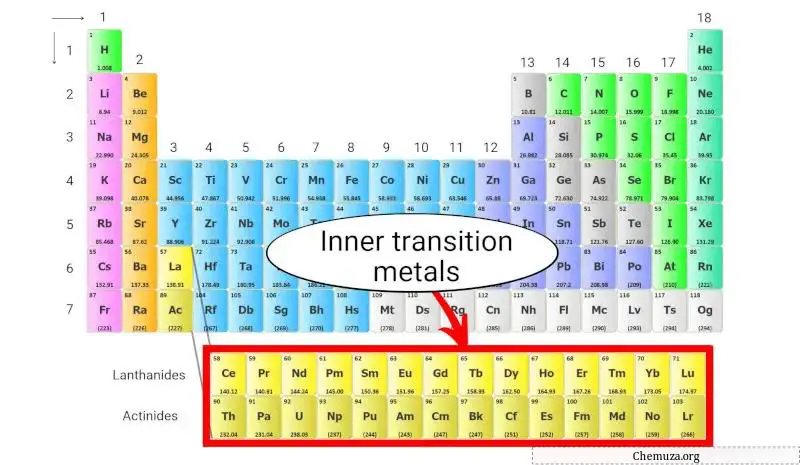
De interne overgangsmetalen zijn een groep chemische elementen die zich in de onderste twee rijen van het periodiek systeem bevinden, net onder het hoofdblok van het overgangsmetaal .
Interne overgangsmetalen zijn verdeeld in twee groepen:
- Lanthaniden , die atoomnummers hebben variërend van 57 tot 71, en
- Actiniden , die atoomnummers hebben variërend van 89 tot 103.
Laten we meer van de interne overgangselementen van het periodiek systeem onderzoeken.
Wat zijn interne overgangsmetalen? En waarom staan ze onderaan?
De interne overgangsmetalen vormen de groep elementen die onderaan het periodiek systeem zijn geplaatst.
Deze interne overgangsmetalen zijn slechts een deel van de overgangsmetalen en hebben ook vergelijkbare eigenschappen als overgangsmetalen. Maar ze worden in het binnengedeelte geplaatst als verlengstuk van groep 3.
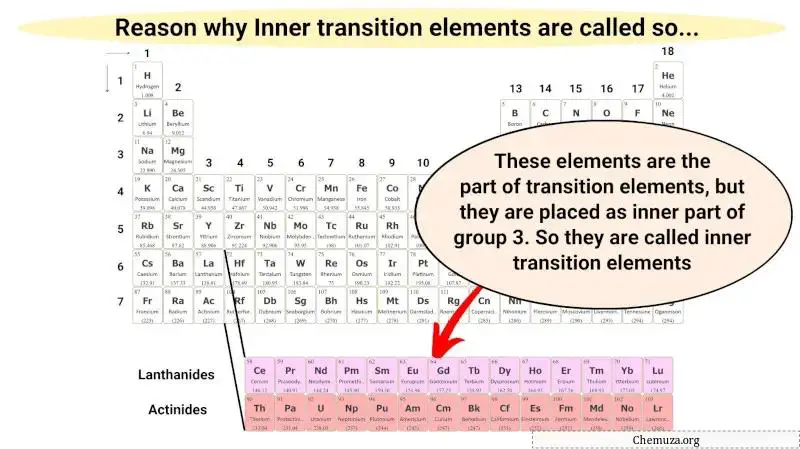
Daarom worden deze metalen elementen interne overgangsmetalen genoemd.
Waarom staan ze onderaan het periodiek systeem?
Als de interne overgangsmetalen als een uitbreiding van groep 3 worden geplaatst, lijkt het periodiek systeem erg lang (zoals hieronder weergegeven).

Om het op A4-formaat papier te laten passen, worden de 2 rijen overgangsmetalen aan de onderkant geplaatst.
Bovendien hebben deze interne overgangselementen hun valentie-elektronen in de f-orbitaal , waardoor deze elementen vergelijkbare chemische eigenschappen vertonen.
Het is om deze redenen dat de interne overgangsmetalen onderaan het periodiek systeem worden geplaatst.
Lijst met interne overgangsmetalen
De lijst met interne overgangsmetalen wordt hieronder gegeven.
| Atoomnummer | Symbool | Elementnaam en symbool |
| 57 | Daar | Lanthaan |
| 58 | Dit | Cerium |
| 59 | Pr | Praseodymium |
| 60 | sd | Neodymium |
| 61 | P.M | Promethium |
| 62 | Klein | Samarium |
| 63 | ONS | Europium |
| 64 | God | Gadolinium |
| 65 | tuberculose | Terbium |
| 66 | Dy | Dysprosium |
| 67 | Hoe | Holmium |
| 68 | Eh | Erbium |
| 69 | TM | Thulium |
| 70 | Ja | Ytterbium |
| 71 | Lezen | Lutetium |
| 89 | Ac | Actinium |
| 90 | E | Thorium |
| 91 | Pennsylvania | Protactinium |
| 92 | U | Uranium |
| 93 | Np | Neptunium |
| 94 | Zou kunnen | Plutonium |
| 95 | Ben | Amerika |
| 96 | cm | Curium |
| 97 | BK | Berkelium |
| 98 | Zien | Californië |
| 99 | Is | Einsteinium |
| 100 | FM | fermium |
| 101 | Maryland | Mendelevium |
| 102 | Nee | Nobelium |
| 103 | L/R | Laurens |
Feiten over interne overgangsmetalen
Hier zijn enkele interessante feiten over interne overgangsmetalen:
- Er zijn twee soorten interne overgangsmetalen: lanthaniden en actiniden. Lanthaniden zijn de 15 elementen met atoomnummers variërend van 57 ( lanthaan ) tot 71 ( lutetium ), terwijl actiniden de 15 elementen zijn met atoomnummers variërend van 89 ( actinium ) tot 103 ( lawrencium ).
- Interne overgangsmetalen hebben unieke elektronische configuraties vanwege de aanwezigheid van f-orbitalen. Dit resulteert in ongebruikelijke chemische en fysische eigenschappen, zoals hoge smelt- en kookpunten, complexe ionenvorming en paramagnetisme.
- De meeste interne overgangsmetalen zijn radioactief en sommige zijn gebruikt in kernreactoren en wapens.
- Interne transitiemetalen zijn belangrijk in de technologie en industrie. Neodymium en samarium worden bijvoorbeeld gebruikt om krachtige magneten te maken [1] en cerium wordt gebruikt in katalysatoren om de uitstoot van voertuigen te verminderen. [2]
- Lanthaniden worden ook wel ‘zeldzame aardelementen’ genoemd omdat ze relatief zeldzaam zijn in de aardkorst. Ze zijn echter niet echt zeldzaam en worden in veel mineralen aangetroffen.
- Actiniden zijn allemaal radioactief en sommige, zoals uranium en plutonium , zijn belangrijk voor kernenergie en wapens. Ze vormen echter ook risico’s voor het milieu en de gezondheid vanwege hun radioactiviteit.
- Interne overgangsmetalen zijn al sinds de oudheid bekend en werden gebruikt voor sieraden en decoratie. Ze werden echter pas in de 20e eeuw algemeen bestudeerd of begrepen.
Eigenschappen van interne overgangsmetalen
Hier zijn enkele eigenschappen van interne overgangsmetalen:
- Elektronische configuratie: Interne overgangsmetalen hebben f-orbitalen gedeeltelijk gevuld, waardoor ze unieke elektronische configuraties en ongebruikelijke chemische en fysische eigenschappen hebben.
- Hoge smelt- en kookpunten: Interne overgangsmetalen hebben hoge smelt- en kookpunten vanwege de sterke metaalbinding die het gevolg is van de aanwezigheid van ongepaarde elektronen in de f-orbitalen.
- Paramagnetisme: Interne overgangsmetalen zijn paramagnetisch, wat betekent dat ze worden aangetrokken door een magnetisch veld vanwege de aanwezigheid van ongepaarde elektronen in de f-orbitalen.
- Vorming van complexe ionen: Interne overgangsmetalen kunnen complexe ionen vormen vanwege de beschikbaarheid van lege f-orbitalen, die elektronen van andere atomen of moleculen kunnen huisvesten.
- Radioactiviteit: Veel interne overgangsmetalen zijn radioactief vanwege de aanwezigheid van onstabiele isotopen in hun kernen.
- Oxidatietoestanden: Interne overgangsmetalen vertonen een reeks oxidatietoestanden, waaronder hoge oxidatietoestanden, vanwege de beschikbaarheid van meerdere valentie-elektronen in f-orbitalen.
- Vergelijkbare chemische eigenschappen: Lanthaniden en actiniden hebben vergelijkbare chemische eigenschappen, waardoor ze moeilijk van elkaar te scheiden zijn.
- Metaalglans: Interne overgangsmetalen zijn over het algemeen glanzend en hebben een metaalachtige glans vanwege hun hoge lichtreflectievermogen.
Gebruik van interne overgangsmetalen
Interne overgangsmetalen hebben een breed scala aan toepassingen vanwege hun unieke eigenschappen. Enkele toepassingen van interne overgangsmetalen zijn:
- Kernenergie: Veel interne transitiemetalen, vooral actiniden zoals uranium, worden gebruikt als brandstof voor kernreactoren en wapens.
- Magneten: Lanthaniden zoals neodymium, samarium en gadolinium worden gebruikt om krachtige magneten te maken voor een verscheidenheid aan toepassingen, waaronder harde schijven van computers, windturbines en MRI-machines.
- Verlichting: Lanthaniden zoals europium en terbium worden gebruikt om fosforen te maken voor fluorescentie- en LED-verlichting. [3]
- Katalyse: Lanthaniden zoals cerium worden gebruikt als katalysatoren in veel industriële processen, waaronder aardolieraffinage en bestrijding van vervuiling.
- Glasproductie: Lanthaniden zoals erbium en ytterbium worden gebruikt om glas te kleuren, terwijl cerium wordt gebruikt om glas te polijsten.
- Medische beeldvorming: Lanthaniden zoals gadolinium en terbium worden gebruikt in contrastmiddelen voor MRI-scans. [4]
- Elektronica: Lanthaniden zoals dysprosium en terbium worden gebruikt in elektronische apparaten, zoals microgolffilters en LCD-schermen.
- Defensie: Interne transitiemetalen worden gebruikt in defensietechnologieën, waaronder kernwapens en pantserdoordringende munitie.
Samenvatting
De interne overgangsmetalen zijn een groep chemische elementen die zich in de onderste twee rijen van het periodiek systeem bevinden, net onder het hoofdovergangsmetaalblok.
Ze zijn verdeeld in twee groepen: de Lanthaniden en de Actiniden, die respectievelijk atoomnummers hebben van 57 tot 71 en 89 tot 103.
De locatie van de interne overgangsmetalen bevindt zich onderaan het periodiek systeem omdat hun valentie-elektronen zich in de f-orbitaal bevinden, die vergelijkbare chemische eigenschappen heeft.
Interne overgangsmetalen hebben hoge smelt- en kookpunten, complexe ionenvorming en paramagnetisme. Ze vertonen ook een reeks oxidatietoestanden, waaronder hoge oxidatietoestanden, vanwege de beschikbaarheid van meerdere valentie-elektronen in de f-orbitalen.
