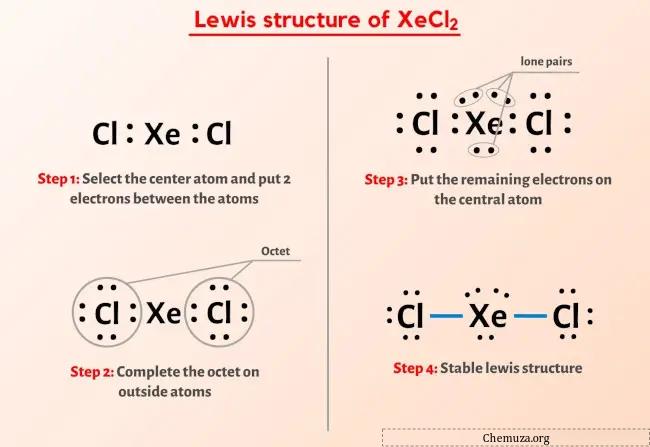
Dus je hebt de afbeelding hierboven al gezien, toch?
Ik zal het bovenstaande beeld kort toelichten.
De Lewis-structuur van XeCl2 heeft een xenon (Xe) atoom in het midden dat wordt omgeven door twee chlooratomen (Cl). Er zijn twee enkele bindingen tussen het xenonatoom (Xe) en elk chlooratoom (Cl). Er zijn 3 eenzame paren op het xenon (Xe) atoom, evenals de twee chloor (Cl) atomen.
Als je niets hebt begrepen van de bovenstaande afbeelding van de Lewis-structuur van XeCl2 (xenondichloride), blijf dan bij mij en je krijgt de gedetailleerde stap-voor-stap uitleg over het tekenen van een Lewis-structuur van XeCl2 .
Laten we dus verder gaan met de stappen voor het tekenen van de Lewis-structuur van XeCl2.
Stappen voor het tekenen van de Lewis-structuur van XeCl2
Stap 1: Zoek het totale aantal valentie-elektronen in het XeCl2-molecuul
Om het totale aantal valentie-elektronen in het molecuul te vinden
(Valentie-elektronen zijn de elektronen die aanwezig zijn in de buitenste baan van elk atoom.)
Hier zal ik je vertellen hoe je gemakkelijk de valentie-elektronen van xenon en chloor kunt vinden met behulp van een periodiek systeem.
Totale valentie-elektronen in het XeCl2-molecuul
→ Valentie-elektronen gegeven door het xenonatoom:
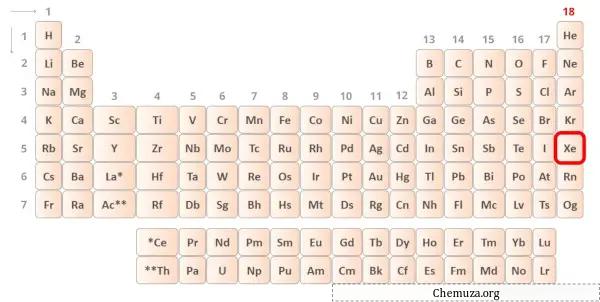
Xenon is een element in groep 18 van het periodiek systeem. [1] Daarom zijn de valentie-elektronen in xenon 8 .
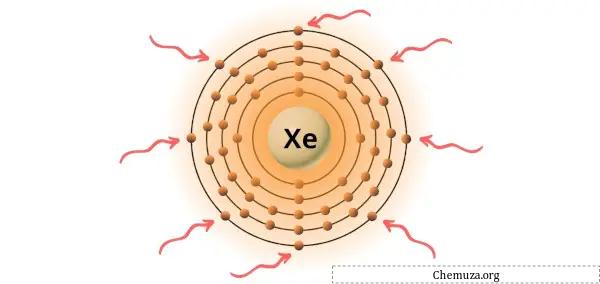
Je kunt de 8 valentie-elektronen zien die aanwezig zijn in het xenonatoom, zoals weergegeven in de afbeelding hierboven.
→ Valentie-elektronen gegeven door het chlooratoom:

Chloor is een element in groep 17 van het periodiek systeem. [2] Daarom zijn de valentie-elektronen in chloor 7 .
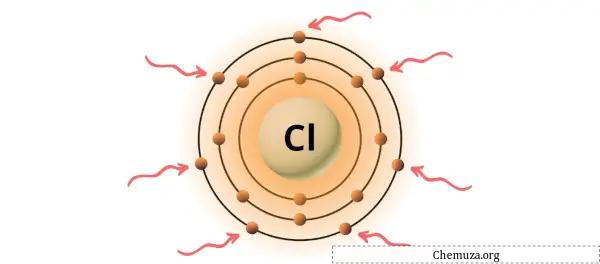
Je kunt de 7 valentie-elektronen in het chlooratoom zien, zoals weergegeven in de afbeelding hierboven.
Dus,
Totale valentie-elektronen in het XeCl2-molecuul = valentie-elektronen gedoneerd door 1 xenonatoom + valentie-elektronen gedoneerd door 2 chlooratomen = 8 + 7(2) = 22 .
Stap 2: Selecteer het centrale atoom
Om het centrale atoom te selecteren, moeten we onthouden dat het minst elektronegatieve atoom in het centrum blijft.
Het gegeven molecuul is hier XeCl2 (xenondichloride) en het bevat xenon- (Xe)-atomen en chloor- (Cl)-atomen.
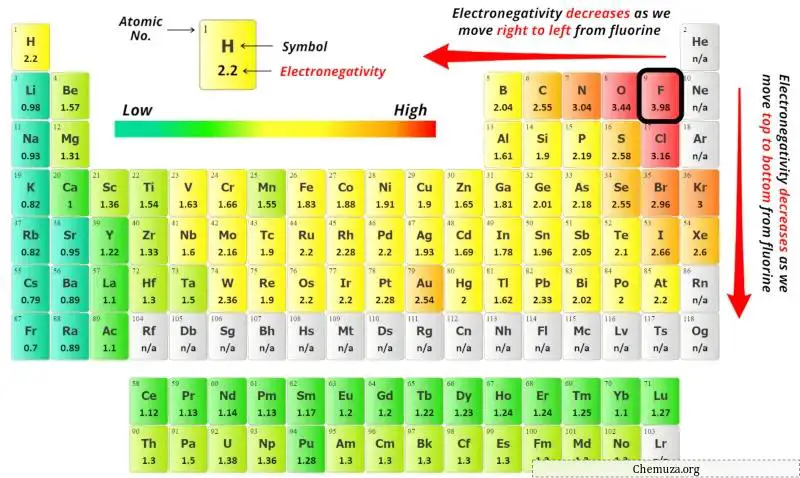
Je kunt de elektronegativiteitswaarden van het xenonatoom (Xe) en het chlooratoom (Cl) zien in het periodiek systeem hierboven.
Als we de elektronegativiteitswaarden van xenon (Xe) en chloor (Cl) vergelijken, dan is het xenonatoom minder elektronegatief .
Hier is het xenonatoom (Xe) het centrale atoom en de chlooratomen (Cl) de buitenste atomen.
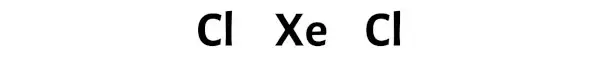
Stap 3: Verbind elk atoom door er een paar elektronen tussen te plaatsen
Nu moet je in het XeCl2-molecuul de elektronenparen tussen het xenonatoom (Xe) en de chlooratomen (Cl) plaatsen.
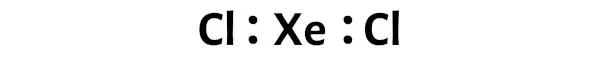
Dit geeft aan dat xenon (Xe) en chloor (Cl) chemisch aan elkaar gebonden zijn in een XeCl2-molecuul.
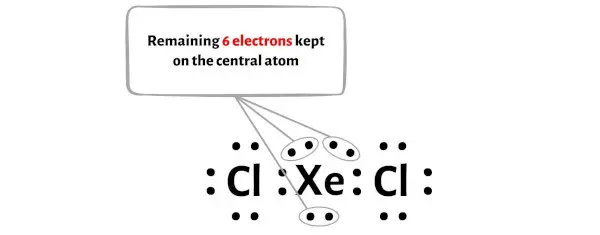
Stap 4: Maak de externe atomen stabiel. Plaats het resterende valentie-elektronenpaar op het centrale atoom.
In deze stap moet je de stabiliteit van de externe atomen controleren.
Hier in de schets van het XeCl2-molecuul kun je zien dat de buitenste atomen chlooratomen zijn.
Deze externe chlooratomen vormen een octet en zijn daarom stabiel.
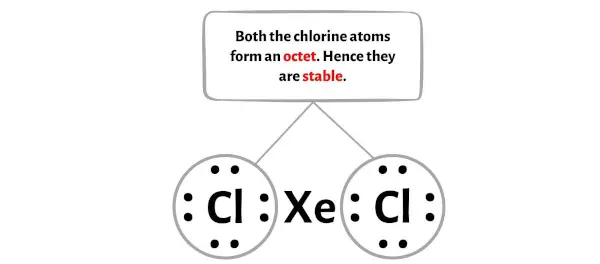
Bovendien hebben we in stap 1 het totale aantal valentie-elektronen berekend dat aanwezig is in het XeCl2-molecuul.
Het XeCl2-molecuul heeft in totaal 22 valentie-elektronen en hiervan worden in het bovenstaande diagram slechts 16 valentie-elektronen gebruikt.
Dus het aantal resterende elektronen = 22 – 16 = 6 .
Je moet deze 6 elektronen op het centrale xenonatoom in het diagram hierboven van het XeCl2-molecuul plaatsen.
Laten we nu verder gaan met de volgende stap.
Stap 5: Controleer de stabiliteit van de Lewis-structuur
Nu ben je bij de laatste stap gekomen waarin je de stabiliteit van de Lewis-structuur van XeCl2 moet controleren.
De stabiliteit van de Lewis-structuur kan worden geverifieerd met behulp van een formeel ladingsconcept .
Kortom, we moeten nu de formele lading vinden van de xenonatomen (Xe) en van de chlooratomen (Cl) die aanwezig zijn in het XeCl2-molecuul.
Om de formele belasting te berekenen, moet u de volgende formule gebruiken:
Formele lading = Valentie-elektronen – (bindende elektronen)/2 – Niet-bindende elektronen
In de onderstaande afbeelding kunt u het aantal bindende elektronen en niet-bindende elektronen voor elk atoom van het XeCl2-molecuul zien.
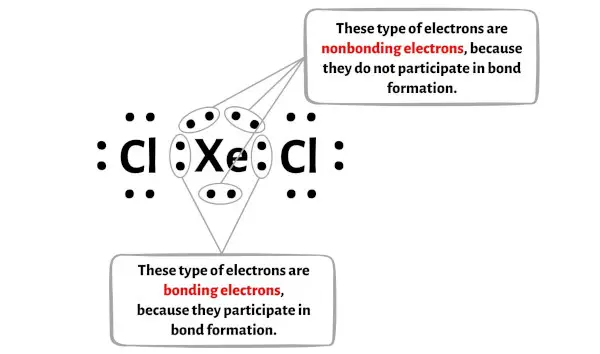
Voor het Xenon-atoom (Xe):
Valentie-elektronen = 8 (omdat xenon in groep 18 zit)
Bindende elektronen = 4
Niet-bindende elektronen = 6
Voor het chlooratoom (Cl):
Elektronenvalentie = 7 (omdat chloor in groep 17 zit)
Bindende elektronen = 2
Niet-bindende elektronen = 6
| Formele beschuldiging | = | valentie-elektronen | – | (Bindende elektronen)/2 | – | Niet-bindende elektronen | ||
| Xe | = | 8 | – | 4/2 | – | 6 | = | 0 |
| Kl | = | 7 | – | 2/2 | – | 6 | = | 0 |
Uit de bovenstaande formele ladingsberekeningen kun je zien dat zowel het xenon (Xe) atoom als het chloor (Cl) atoom een formele lading “nul” hebben.
Dit geeft aan dat de bovenstaande Lewis-structuur van XeCl2 stabiel is en dat er geen verdere verandering is in de bovenstaande structuur van XeCl2.
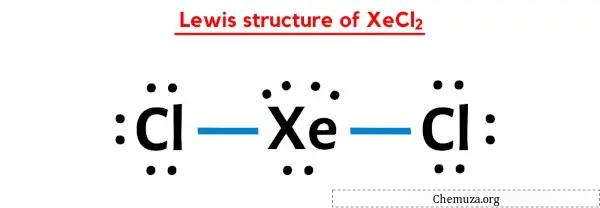
In de bovenstaande Lewis-puntstructuur van XeCl2 kun je elk paar bindende elektronen (:) ook voorstellen als een enkele binding (|). Als u dit doet, ontstaat de volgende Lewis-structuur van XeCl2.
Ik hoop dat je alle bovenstaande stappen volledig hebt begrepen.
Voor meer oefening en een beter begrip kun je andere Lewis-structuren proberen die hieronder worden vermeld.
Probeer (of bekijk in ieder geval) deze Lewis-structuren voor een beter begrip:
