Kaliumdichromaat is een feloranje chemische verbinding die in verschillende toepassingen wordt gebruikt. Het is een sterk oxidatiemiddel en kan giftig zijn bij inslikken of inademen.
| IUPAC-naam | Dichromaat kalium |
| Moleculaire formule | K2Cr2O7 |
| CAS-nummer | 7778-50-9 |
| Synoniemen | Kaliumdichromaat, Kaliumchromaat (VI), Kaliumdichromaat |
| InChi | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;/h;;2*;7*1- |
Eigenschappen van kaliumdichromaat
Kaliumdichromaatformule
De formule voor kaliumdichromaat is K2Cr2O7. Het bestaat uit twee kaliumatomen (K), twee chroomatomen (Cr) en zeven zuurstofatomen (O). Elk kaliumatoom heeft een lading van +1, terwijl elk chroomatoom een lading van +6 heeft. De aanwezigheid van twee chroomatomen in de formule geeft de dimere structuur van de verbinding aan.
Kaliumdichromaat Molaire massa
De molaire massa van kaliumdichromaat wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Kalium heeft een molaire massa van 39,10 gram per mol (g/mol), chroom heeft een molaire massa van 52,00 g/mol en zuurstof heeft een molaire massa van 16,00 g/mol. De molaire massa van kaliumdichromaat is daarom 294,18 g/mol.
Kookpunt van kaliumdichromaat
Kaliumdichromaat heeft geen specifiek kookpunt, omdat het ontleedt voordat het een kookpunt bereikt. Bij verhitting ondergaat het echter thermische ontleding, waarbij giftige dampen van chroomoxide en zuurstof vrijkomen.
Kaliumdichromaat Smeltpunt
Het smeltpunt van kaliumdichromaat is ongeveer 398 graden Celsius (°C) of 748 graden Fahrenheit (°F). Bij deze temperatuur veranderen de vaste kristallen van kaliumdichromaat in een vloeibare toestand.
Dichtheid van kaliumdichromaat g/ml
De dichtheid van kaliumdichromaat is ongeveer 2,68 gram per milliliter (g/ml). Dit geeft aan dat een bepaald volume kaliumdichromaat relatief zwaarder is dan een gelijk volume water.
Kaliumdichromaat Molecuulgewicht
Het molecuulgewicht van kaliumdichromaat is hetzelfde als de molaire massa, namelijk 294,18 gram per mol (g/mol). Het vertegenwoordigt de gecombineerde massa van alle atomen die aanwezig zijn in een molecuul van de verbinding.
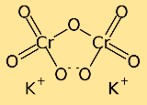
Structuur van kaliumdichromaat
Kaliumdichromaat heeft een dimere structuur, wat betekent dat het bestaat uit twee chroomatomen die aan elkaar zijn gebonden door zuurstofatomen. Kaliumatomen zijn ook gebonden aan zuurstofatomen, waardoor een complex netwerk van atomen in de verbinding ontstaat.
Oplosbaarheid van kaliumdichromaat
Kaliumdichromaat is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een oranje oplossing. De oplosbaarheid van kaliumdichromaat neemt toe met de temperatuur. De oplosbaarheid ervan in organische oplosmiddelen is echter beperkt.
| Verschijning | Helder oranje kristallen |
| Soortelijk gewicht | 2,68 g/ml |
| Kleur | Oranje |
| Geur | Geurloos |
| Molaire massa | 294,18 g/mol |
| Dikte | 2,68 g/ml |
| Fusie punt | 398°C (748°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, beperkt in organische oplosmiddelen |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet toepasbaar |
| pH | Zuur (rond pH 4) |
Veiligheid en gevaren van kaliumdichromaat
Kaliumdichromaat brengt aanzienlijke veiligheidsrisico’s met zich mee. Het is zeer giftig als het wordt ingeslikt, ingeademd of in contact komt met de huid. De verbinding is een sterk oxidatiemiddel dat heftig kan reageren met brandbare materialen, waardoor het risico op brand toeneemt. Blootstelling aan kaliumdichromaat kan ernstige huidirritatie, brandwonden en allergische reacties veroorzaken. Het inademen van de dampen of het stof kan ademhalingsproblemen en longschade veroorzaken. Langdurige blootstelling wordt in verband gebracht met nadelige gezondheidseffecten, waaronder door chromaat geïnduceerde longkanker. Het is essentieel om uiterst voorzichtig om te gaan met kaliumdichromaat, het dragen van geschikte beschermende uitrusting en het zorgen voor voldoende ventilatie om gezondheids- en veiligheidsrisico’s tot een minimum te beperken.
| Gevarensymbolen | Bijtend, gevaar voor de gezondheid, acuut giftig |
| Beveiligingsbeschrijving | – Zeer giftig – Bijtend – Veroorzaakt brandwonden |
| VN-identificatienummers | UN 3086 (klasse 6.1) |
| HS-code | 2841.10.10 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Acute orale toxiciteit: Zeer giftig<br>Chronische toxiciteit: Kankerverwekkend potentieel |
Opmerking: De in de tabel gebruikte gevarensymbolen zijn algemeen erkende internationale symbolen. Het is belangrijk om de specifieke voorschriften en veiligheidsinstructies te raadplegen voor volledige informatie over de hantering en opslag van kaliumdichromaat.
Kaliumdichromaatsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van kaliumdichromaat. Een veelgebruikte methode is de reactie tussen kaliumchromaat (K2CrO4) en chroomzuur (H2CrO4) . De reactie vindt plaats in een zuur milieu, meestal met zwavelzuur (H2SO4) als katalysator. De reactie kan het samenvatten.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Een andere methode omvat de oxidatie van kaliumchromaat met behulp van een sterk oxidatiemiddel, zoals geconcentreerd zwavelzuur (H2SO4) , en een reductiemiddel, zoals ethanol (C2H5OH). De reactie kan het samenvatten.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
Kaliumhydroxide (KOH) reageert met chroomtrioxide (CrO3) in een waterig medium om kaliumdichromaat te produceren. In een waterig medium vindt de reactie plaats. De reactie kan het samenvatten.
2KOH + CrO3 → K2Cr2O7 + H2O
Deze synthesemethoden vereisen passende veiligheidsmaatregelen vanwege de toxische en corrosieve aard van de betrokken reagentia. Het is belangrijk om deze reacties uit te voeren in een goed geventileerde ruimte, beschermende uitrusting te dragen en zorgvuldig met chemicaliën om te gaan. Bovendien is het volgen van de juiste afvalverwerkingsprotocollen essentieel om de impact op het milieu te minimaliseren.
Gebruik van kaliumdichromaat
Kaliumdichromaat vindt vanwege zijn unieke eigenschappen toepassingen op verschillende gebieden. Hier zijn enkele van de meest voorkomende toepassingen:
- Oxidatiemiddel: Bij chemische reacties wordt kaliumdichromaat op grote schaal gebruikt als een sterk oxidatiemiddel om alcoholen te oxideren tot aldehyden of ketonen.
- Laboratoriumreagens: Analytische chemie gebruikt kaliumdichromaat als reagens voor tests en experimenten, inclusief het bepalen van organische verbindingen en het uitvoeren van redoxreacties.
- Looi-industrie: De leerindustrie gebruikt kaliumdichromaat als looimiddel om dierenhuiden te behandelen en er duurzame leerproducten van te maken.
- Fotografie: Zwart-witfotografie verwerkt kaliumdichromaat in ontwikkelingsoplossingen en gebruikt het om emulsies gevoelig te maken om specifieke fotografische effecten te bereiken.
- Houtverduurzaming: Om hout te beschermen tegen rot, schimmels en insecten, gebruikt de houtverduurzamingsindustrie kaliumdichromaat als een zeer giftig houtverduurzamingsmiddel.
- Pigmentproductie: Kaliumdichromaat speelt een cruciale rol bij de productie van pigmenten zoals chroomgeel en chroomoranje, die industrieën gebruiken in verven, inkten en kleurstoffen.
- Galvaniseren: Bij galvaniseerprocessen wordt gebruik gemaakt van kaliumdichromaat om een decoratieve, corrosiebestendige coating aan te brengen op metalen, waaronder zink, aluminium en messing.
- Pyrotechniek: Kaliumdichromaat speelt een essentiële rol in pyrotechnische mengsels en geeft feloranje kleuren aan vuurwerk en fakkels.
- Textielindustrie: Bij het verven en bedrukken van textiel wordt kaliumdichromaat gebruikt om de gewenste kleuren te verkrijgen en de kleurechtheid te verbeteren.
- Kalibratie van laboratoriumglaswerk: Voor nauwkeurige volumemetingen worden kaliumdichromaatoplossingen gebruikt om laboratoriumglaswerk te kalibreren.
Deze uiteenlopende toepassingen benadrukken de veelzijdigheid en het belang van kaliumdichromaat in verschillende industrieën en wetenschappelijke inspanningen.
Vragen:
Vraag: Wat is de juiste formule voor kaliumdichromaat?
A: De juiste formule voor kaliumdichromaat is K2Cr2O7.
Vraag: Wat is kaliumdichromaat?
A: Kaliumdichromaat is een feloranje chemische verbinding en wordt vaak gebruikt als oxidatiemiddel.
Vraag: Is kaliumdichromaat ionisch of covalent?
A: Kaliumdichromaat is een ionische verbinding.
Vraag: Wat is de minimale hoeveelheid water die nodig is om 3 mol kaliumdichromaat op te lossen?
A: De minimale hoeveelheid water die nodig is om 3 mol kaliumdichromaat op te lossen is ongeveer 564 gram.
Vraag: Wat is de molaire massa van kaliumdichromaat?
A: De molaire massa van kaliumdichromaat is 294,18 gram per mol (g/mol).
Vraag: Kaliumdichromaat MSDS?
A: Veiligheidsinformatiebladen (MSDS) voor kaliumdichromaat geven gedetailleerde informatie over de gevaren, hantering, opslag en eerstehulpmaatregelen. Raadpleeg betrouwbare bronnen of fabrikanten voor de specifieke MSDS.
Vraag: Hoe wordt kaliumdichromaat bereid uit chromieterts?
A: Kaliumdichromaat kan worden bereid uit chromieterts door het te roosteren met kaliumhydroxide of kaliumcarbonaat en het product vervolgens te isoleren.
Vraag: Hoeveel gram kaliumdichromaat is aan de maatkolf toegevoegd?
A: Het exacte aantal gram kaliumdichromaat dat aan de maatkolf wordt toegevoegd, hangt af van de gewenste concentratie en het gewenste volume van de oplossing.
Vraag: Hoe zou u onderscheid maken tussen propanal en propanon met behulp van aangezuurd kaliumdichromaat?
A: Propanal zou worden geoxideerd tot propaanzuur door aangezuurd kaliumdichromaat, terwijl propanon (aceton) geen reactie zou vertonen.
Vraag: Is kaliumdichromaat een reductiemiddel?
A: Nee, kaliumdichromaat is een oxidatiemiddel.
Vraag: Hoe schrijf je de formule voor kaliumdichromaat?
A: De formule voor kaliumdichromaat is K2Cr2O7.
