Magnesiumchloraat (Mg(ClO3)2) is een verbinding bestaande uit Mg2+- en ClO3–ionen. Het is een in water oplosbaar en zeer reactief wit kristallijn poeder. Het kan worden gebruikt als oxidatiemiddel bij de productie van vuurwerk en als ontsmettingsmiddel bij waterbehandeling.
| IUPAC-naam | Magnesiumchloraat |
| Moleculaire formule | Mg(ClO3)2 |
| CAS-nummer | 10326-21-3 |
| Synoniemen | Magnesiumdiperchloraat, magnesium(II)chloraat, magnesiumchloraathexahydraat |
| InChi | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Eigenschappen van magnesiumchloraat
Magnesiumchloraatformule
Magnesiumchloraat is een chemische verbinding met de formule Mg(ClO3)2. De verbinding bestaat uit één magnesiumion (Mg2+) en twee ClO3-ionen. De chemische formule stelt dat één molecuul magnesiumchloraat twee chloride-ionen en zes zuurstofatomen bevat.
Magnesiumchloraat Molaire massa
De molaire massa van Mg(ClO3)2 bedraagt 191,2 g/mol. Deze waarde wordt berekend door de atoomgewichten van de elementen aanwezig in een molecuul Mg(ClO3)2 op te tellen. Magnesium heeft een molaire massa van 24,31 g/mol, terwijl chloor en zuurstof respectievelijk een molaire massa van 35,45 g/mol en 16,00 g/mol hebben. Door de molaire massa van elk element te vermenigvuldigen met het aantal atomen van dat element in het molecuul en deze op te tellen, verkrijgen we de molaire massa van de verbinding.
Kookpunt van magnesiumchloraat
Mg(ClO3)2 ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt Mg(ClO3)2 uiteen in magnesiumchloride, zuurstofgas en chloorgas. Daarom heeft Mg(ClO3)2 geen kookpunt.
Magnesiumchloraat Smeltpunt
Het smeltpunt van Mg(ClO3)2 bedraagt 105°C. Bij deze temperatuur verandert de vaste verbinding in vloeibare vorm. Het smeltpunt van Mg(ClO3)2 kan variëren afhankelijk van de zuiverheid van de verbinding en de omstandigheden waaronder deze wordt gemeten.
Dichtheid van magnesiumchloraat g/ml
De dichtheid van Mg(ClO3)2 bedraagt 2,21 g/ml. Dit betekent dat één milliliter Mg(ClO3)2 een massa heeft van 2,21 gram. De dichtheid van Mg(ClO3)2 kan worden gebruikt om het volume van een bepaalde massa van de verbinding of de massa van een bepaald volume van de verbinding te berekenen.
Magnesiumchloraat Molecuulgewicht
Het molecuulgewicht van Mg(ClO3)2 bedraagt 191,2 g/mol. Deze waarde wordt berekend door de atoomgewichten van de elementen aanwezig in een molecuul Mg(ClO3)2 op te tellen.
Structuur van magnesiumchloraat
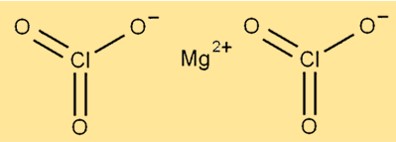
De structuur van Mg(ClO3)2 bestaat uit magnesiumionen omgeven door zes zuurstofatomen en twee chlooratomen. Het magnesiumion bevindt zich in het midden van het molecuul, terwijl de zuurstof- en chlooratomen eromheen zijn gerangschikt. De verbinding heeft een kristallijne structuur en is wit van kleur.
Oplosbaarheid van magnesiumchloraat
Mg(ClO3)2 is oplosbaar in water, ethanol en aceton. De oplosbaarheid van Mg(ClO3)2 in water neemt toe met de temperatuur. Bij kamertemperatuur kan ongeveer 31 gram Mg(ClO3)2 oplossen in 100 ml water. De oplosbaarheid van Mg(ClO3)2 in andere oplosmiddelen hangt af van de polariteit van het oplosmiddel.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2,21 g/cm3 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 191,2 g/mol |
| Dikte | 2,21 g/ml |
| Fusie punt | 105°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, ethanol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van magnesiumchloraat
Mg(ClO3)2 is een sterk oxidatiemiddel en kan heftig reageren met brandbare materialen, waardoor brand of explosies kunnen ontstaan. Het kan ook irritatie van de huid, ogen en luchtwegen veroorzaken bij contact of inademing. Daarom moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gebruikt bij het hanteren van Mg(ClO3)2. De verbinding moet ook uit de buurt van brandbare materialen en warmte- of ontstekingsbronnen worden bewaard. Bovendien moet er voor voldoende ventilatie worden gezorgd om inademing van stof of damp uit de verbinding te voorkomen. Er moet met voorzichtigheid worden omgegaan met Mg(ClO3)2 om mogelijke gevaren te voorkomen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Vermijd contact met brandbare materialen, draag handschoenen en een veiligheidsbril, zorg voor voldoende ventilatie |
| VN-identificatienummers | VN1475 |
| HS-code | 2829.90.90 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Kan irritatie aan de huid, ogen en luchtwegen veroorzaken; kan schadelijk zijn bij inslikken |
Magnesiumchloraatsynthesemethoden
Er kunnen verschillende methoden worden gebruikt om Mg(ClO3)2 te synthetiseren.
Een gebruikelijke methode is om magnesiumhydroxide te laten reageren met chloorzuur. De reactie verloopt als volgt:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Een andere methode is om magnesiumcarbonaat te laten reageren met perchloorzuur. De reactie verloopt als volgt:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Een derde methode omvat de elektrolyse van magnesiumchloride in aanwezigheid van een chloraatzout, zoals natrium- of kaliumchloraat. De reactie verloopt als volgt:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Bij deze methode wordt bij het elektrolyseproces gebruik gemaakt van een magnesiumanode en wordt chloraatzout als oxidatiemiddel gebruikt.
Gebruik van magnesiumchloraat
Mg(ClO3)2 heeft verschillende toepassingen op verschillende gebieden. Hier zijn enkele van de toepassingen:
- Pyrotechnische producten: Vaak gebruikt als oxidatiemiddel in pyrotechnische samenstellingen, zoals fakkels, vuurwerk en signaalapparatuur.
- Chemische synthese: Gebruikt als zuurstofbron bij de synthese van verschillende chemicaliën, waaronder farmaceutische producten, kleurstoffen en explosieven.
- Bleekmiddel: Gebruikt als bleekmiddel bij de productie van papier, pulp en textiel.
- Waterbehandeling: Wordt ook gebruikt als waterbehandelingsmiddel om onzuiverheden en bacteriën in water te verwijderen.
- Laboratoriumreagens: Gebruikt als laboratoriumreagens in verschillende analytische chemische methoden.
- Landbouw: Gebruikt als meststof en bodemverbeteraar om planten van magnesium en zuurstof te voorzien.
- Olie- en gasindustrie: Gebruikt als oxidatiemiddel bij boor- en explosiewerkzaamheden in de olie- en gasindustrie.
Vragen:
Vraag: Wat is de formule voor magnesiumchloraat?
A: Mg(ClO3)2.
Vraag: Hoeveel atomen zitten er in 2,1 mol Mg(ClO3)2?
A: Er zijn 5,04 x 10^24 atomen in 2,1 mol Mg(ClO3)2.
Vraag: Magnesiumchloraat valt uiteen in wat?
A: Mg(ClO3)2 kan bij verhitting worden omgezet in magnesiumchloride, zuurstofgas en chloorgas.
Vraag: Hoe wordt magnesiumchloraat afgebroken?
A: Mg(ClO3)2 valt bij verhitting uiteen in magnesiumchloride en zuurstofgas.
Vraag: Wat is het totale aantal zuurstofatomen dat aanwezig is in één eenheid Mg(ClO3)2?
A: Er zijn 6 zuurstofatomen aanwezig in één eenheid Mg(ClO3)2.
Vraag: Waarin valt Mg(ClO3)2 uiteen?
A: Mg(ClO3)2 ontleedt bij verhitting tot MgCl2 en O2.
Vraag: Wat is het totale aantal mol zuurstofatomen dat aanwezig is in één mol Mg(ClO3)2?
A: Er zijn 6 mol zuurstofatomen aanwezig in één mol Mg(ClO3)2.
Vraag: Wat is de massa in gram Mg(ClO3)2?
A: De formulemassa in gram Mg(ClO3)2 is 232,21 g/mol.
Vraag: Is Mg(ClO3)2 ionisch of moleculair?
A: Mg(ClO3)2 is een ionische verbinding.
