Calciumchloraat (Ca(ClO3)2) is een chemische verbinding bestaande uit calcium, chloor en zuurstof. Het wordt vaak gebruikt als oxidatiemiddel in vuurwerk en lucifers. Het kan ook worden gebruikt voor het steriliseren van apparatuur in de voedingsmiddelenindustrie.
| IUPAC-naam | Calciumchloraat |
| Moleculaire formule | Ca(ClO3)2 |
| CAS-nummer | 10137-74-3 |
| Synoniemen | Chloorzuur, calciumzout; Gehydrateerd calciumchloraat; Calciumperchloraat; Calciochloriet; VN1456 |
| InChi | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Eigenschappen van calciumchloraat
Calciumchloraatformule
De formule voor calciumchloraat is Ca(ClO3)2. Het bestaat uit één Ca2+-ion en twee ClO3–ionen. Calciumchloraat is een ionische verbinding, wat betekent dat het bij elkaar wordt gehouden door elektrostatische aantrekking tussen positieve en negatieve ionen.
Calciumchloraat Molaire massa
De molmassa van Ca(ClO3)2 bedraagt 206,98 g/mol. Dit kan worden berekend door de atoommassa’s calcium, chloor en zuurstof waaruit de verbinding bestaat op te tellen. De molaire massa is belangrijk voor het berekenen van de hoeveelheid Ca(ClO3)2 die nodig is voor een bepaalde reactie.
Kookpunt van calciumchloraat
Ca(ClO3)2 heeft geen kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt Ca(ClO3)2 uiteen in calciumchloride (CaCl2) en zuurstofgas (O2). Deze ontleding is exotherm en kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan.
Calciumchloraat Smeltpunt
Het smeltpunt van Ca(ClO3)2 bedraagt 135°C. Dit is de temperatuur waarbij de vaste verbinding verandert van vast naar vloeibaar. Ca(ClO3)2 is bij kamertemperatuur en druk een witte kristallijne vaste stof.
Dichtheid van calciumchloraat g/ml
De dichtheid van Ca(ClO3)2 bedraagt 2,4 g/ml. Dit betekent dat één milliliter Ca(ClO3)2 2,4 gram weegt. Dichtheid is een maat voor de dichtheid van moleculen in een stof. Ca(ClO3)2 heeft een hogere dichtheid dan water, dat een dichtheid heeft van 1 g/ml.
Calciumchloraat Molecuulgewicht
Het molecuulgewicht van Ca(ClO3)2 bedraagt 206,98 g/mol. Het is hetzelfde als de molaire massa en kan worden berekend door de atoomgewichten van de afzonderlijke elementen in de verbinding op te tellen.
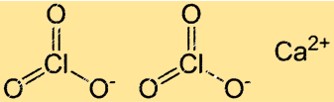
Structuur van calciumchloraat
Ca(ClO3)2 heeft een kristalroosterstructuur die typerend is voor ionische verbindingen. In deze structuur zijn de Ca2+- en ClO3–ionen gerangschikt in een regelmatig, zich herhalend patroon. Elk Ca2+-ion is omgeven door zes ClO3-ionen en elk chloraation is omgeven door zes calciumionen.
Oplosbaarheid van calciumchloraat
Ca(ClO3)2 is oplosbaar in water en vormt een heldere, kleurloze oplossing. De oplosbaarheid van Ca(ClO3)2 in water neemt toe met de temperatuur. Het is echter minder oplosbaar in organische oplosmiddelen zoals ethanol en aceton. Ca(ClO3)2 is ook hygroscopisch, wat betekent dat het vocht uit de lucht absorbeert. Hierdoor kan de verbinding nat worden of na verloop van tijd oplossen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2.4 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 206,98 g/mol |
| Dikte | 2,4 g/ml |
| Fusie punt | 135°C |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, minder oplosbaar in organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van calciumchloraat
Ca(ClO3)2 wordt beschouwd als een gevaarlijke stof en er moet voorzichtig mee worden omgegaan. Het is een oxidatiemiddel dat heftig kan reageren met organische materialen, waardoor brand en explosies kunnen ontstaan. Inademing of inname van Ca(ClO3)2 kan irritatie van de luchtwegen en het maagdarmkanaal veroorzaken. Langdurige blootstelling kan huidirritatie, brandwonden en mogelijke allergische reacties veroorzaken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen bij het hanteren van Ca(ClO3)2, inclusief handschoenen, een veiligheidsbril en een gasmasker. Bij blootstelling dient u onmiddellijk medische hulp in te roepen. Bewaar Ca(ClO3)2 op een koele, droge, goed geventileerde plaats, uit de buurt van onverenigbare stoffen.
| Gevarensymbolen | O, Xn |
| Beveiligingsbeschrijving | Verwijderd houden van organische materialen. Draag persoonlijke beschermingsmiddelen. Opslaan op een koele, droge, goed geventileerde plaats. |
| VN-identificatienummers | VN1458 |
| HS-code | 2829.11.00 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen. Kan huid- en oogirritatie veroorzaken. Kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van calciumchloraat
Om Ca(ClO3)2 te synthetiseren kunnen we verschillende methoden gebruiken.
Een gebruikelijke methode omvat de reactie van calciumhydroxide met chloorgas. Bij dit proces wordt eerst calciumchloride gevormd als bijproduct, dat reageert met het resterende chloor en zo Ca(ClO3)2 vormt.
Een andere methode omvat de reactie van calciumcarbonaat met salpeterzuur en chloorgas. Om Ca(ClO3)2 te verkrijgen wordt de verkregen oplossing ingedampt en gekristalliseerd.
Een andere benadering omvat de elektrolyse van een oplossing die calciumchloride en natriumchloraat bevat. Dit proces levert Ca(ClO3)2 en natriumchloride op als eindproducten.
Bij de reactie tussen calciumhypochloriet en natriumchloraat ontstaat Ca(ClO3)2, dat vervolgens wordt gezuiverd en gekristalliseerd.
Gebruik van calciumchloraat
Ca(ClO3)2 heeft verschillende belangrijke toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen van Ca(ClO3)2:
- Bleekmiddel: Gebruikt als bleekmiddel in de pulp- en papierindustrie.
- Vuurwerk: Een oxidatiemiddel dat gewoonlijk wordt gebruikt bij de productie van vuurwerk.
- Lucifers: Wordt ook gebruikt bij de productie van veiligheidslucifers, omdat deze gemakkelijk kunnen worden ontstoken.
- Herbiciden: Gebruikt als herbicide omdat het selectief bepaalde onkruiden kan doden zonder de gewassen te beschadigen.
- Oxidatiemiddel: Gebruikt als oxidatiemiddel bij de productie van andere chemicaliën, zoals perchloraten en chloraten.
- Farmaceutische producten: worden ook gebruikt bij de productie van farmaceutische producten, zoals anti-infectieuze medicijnen.
- Laboratoriumreagens: gebruikt als laboratoriumreagens voor analytische chemie.
- Pigmentproductie: Gebruikt bij de productie van pigmenten, zoals ultramarijnblauw.
Vragen:
Vraag: Wat is de formule voor calciumchloraat?
A: De chemische formule voor calciumchloraat is Ca(ClO3)2.
Vraag: Waar wordt calciumchloraat voor gebruikt?
A: Ca(ClO3)2 heeft verschillende toepassingen in industrieën, zoals bleekmiddel in de pulp- en papierindustrie, oxidatiemiddel bij de productie van andere chemicaliën, herbiciden, productiepigmenten en laboratoriumreagentia.
Vraag: Is calciumchloraat een vaste stof?
A: Ja, Ca(ClO3)2 is een vaste stof bij kamertemperatuur.
Vraag: Waar wordt natriumchloraat het meest aangetroffen en waarvoor wordt calciumchloraat gebruikt?
A: Natriumchloraat wordt het meest aangetroffen in de chemische industrie, waar het wordt gebruikt als oxidatiemiddel en herbicide. Ca(ClO3)2 wordt daarentegen in verschillende industrieën gebruikt als bleekmiddel, oxidatiemiddel en herbicide.
Vraag: Wat is het totale aantal atomen in de verbinding Ca(ClO3)2?
A: De verbinding Ca(ClO3)2 heeft in totaal 13 atomen: 1 calciumatoom, 2 chlooratomen en 6 zuurstofatomen van de twee ClO3-ionen.
Vraag: Wat is het massapercentage chloor in Ca(ClO3)2?
A: De atoommassa van chloor is 35,5 g/mol en de molaire massa van Ca(ClO3)2 is 238,98 g/mol. Het massapercentage chloor in Ca(ClO3)2 is dus (2 x 35,5 g/mol) / 238,98 g/mol x 100% = 29,68%.
Vraag: Hoeveel chlooratomen zitten er in Ca(ClO3)2?
A: Er zijn twee chlooratomen in Ca(ClO3)2, vertegenwoordigd door de twee ClO3-groepen.
Vraag: Wat is de massa van elke verbinding in het oorspronkelijke mengsel van Ca(ClO3)2 en Ca(ClO)2?
A: Het is onmogelijk om de massa van elke verbinding in het oorspronkelijke mengsel te bepalen zonder aanvullende informatie, zoals de totale massa of de massaverhouding tussen de twee verbindingen.
