Magnesiumhypochloriet (Mg(ClO)2) is een chemische verbinding bestaande uit magnesium, zuurstof en chloor. Het wordt gebruikt als ontsmettingsmiddel, bleekmiddel en chemische stof voor waterbehandeling.
| Naam van IUPAC | Magnesiumhypochloriet |
| Moleculaire formule | Mg(ClO)2 |
| CAS-nummer | 10233-03-1 |
| Synoniemen | Magnesiumchloraat, magnesiumzout van hypochloorzuur, magnesiumoxychloride, MagOCl |
| InChi | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Eigenschappen van magnesiumhypochloriet
Magnesiumhypochlorietformule
Magnesiumhypochloriet heeft de chemische formule Mg(ClO)2, wat betekent dat het één magnesiumatoom, twee chlooratomen en twee zuurstofatomen per molecuul bevat. Het is een witte vaste stof met een lichte chloorgeur en wordt vaak gebruikt als ontsmettingsmiddel en chemische stof voor waterbehandeling.
Magnesiumhypochloriet Molaire massa
De molmassa van Mg(ClO)2 bedraagt 127,21 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk element in de chemische formule op te tellen, namelijk magnesium (24,31 g/mol), chloor (35,45 g/mol) en zuurstof (15,99 g/mol). mol), vermenigvuldigd met hun respectievelijke indices.
Kookpunt van magnesiumhypochloriet
Mg(ClO)2 heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting komt bij Mg(ClO)2 zuurstofgas vrij, waardoor magnesiumchloride als vast residu achterblijft.
Magnesiumhypochloriet Smeltpunt
Het smeltpunt van Mg(ClO)2 is 100°C. Bij deze temperatuur veranderen de vaste Mg(ClO)2-kristallen in een vloeistof. Vanwege de instabiliteit bij hoge temperaturen wordt echter aanbevolen er voorzichtig mee om te gaan.
Dichtheid van magnesiumhypochloriet g/ml
De dichtheid van Mg(ClO)2 is 2,08 g/ml bij kamertemperatuur. Dit betekent dat één milliliter Mg(ClO)2 een massa heeft van 2,08 gram.
Magnesiumhypochloriet Moleculair gewicht
Het molecuulgewicht van Mg(ClO)2 bedraagt 127,21 g/mol. Het is de som van de atoomgewichten van alle elementen in de verbinding, namelijk magnesium, chloor en zuurstof.
Structuur van magnesiumhypochloriet
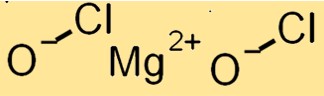
Mg(ClO)2 heeft een kristalstructuur met een monoklien kristalsysteem. Het bestaat uit Mg+2-kationen en ClO-anionen, die bij elkaar worden gehouden door ionische bindingen. De ClO-anionen bevinden zich in een vervormde tetraëdrische opstelling rond de Mg+2-kationen.
Oplosbaarheid van magnesiumhypochloriet
Mg(ClO)2 is enigszins oplosbaar in water, met een oplosbaarheid van 14,6 g/100 ml bij 20°C. Het vormt een enigszins basische oplossing in water als gevolg van de hydrolyse van hypochlorietionen. Het wordt echter niet aanbevolen om Mg(ClO)2 in water op te lossen, omdat hierdoor chloorgas kan ontstaan, dat giftig is en schadelijk kan zijn voor de menselijke gezondheid.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 2,08 g/ml bij 20°C |
| Kleur | Wit |
| Geur | Licht gechloreerd |
| Molaire massa | 127,21 g/mol |
| Dikte | 2,08 g/ml bij 20°C |
| Fusie punt | 100°C |
| Kookpunt | Ontleedt voordat het kookpunt wordt bereikt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar (14,6 g/100 ml bij 20°C) |
| Oplosbaarheid | Enigszins oplosbaar in water, oplosbaar in zuren |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Een beetje basale oplossing |
Veiligheid en gevaren van magnesiumhypochloriet
Mg(ClO)2 kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het is een sterk oxidatiemiddel dat heftig kan reageren met bepaalde chemicaliën. Contact met huid, ogen en slijmvliezen kan irritatie en brandwonden veroorzaken. Het inademen van stof of nevel kan ademhalingsproblemen veroorzaken. Het is ook belangrijk om het mengen van Mg(ClO)2 met zuren of andere chloorhoudende verbindingen te vermijden, omdat hierdoor giftig chloorgas kan ontstaan. Het wordt aanbevolen om beschermende uitrusting zoals handschoenen en een veiligheidsbril te dragen bij het hanteren van Mg(ClO)2 en deze op een koele, droge plaats op te slaan, uit de buurt van incompatibele chemicaliën.
| Gevarensymbolen | Oxidatiemiddel, schadelijk |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en open vuur. Adem geen stof of nevel in. Draag handschoenen en een veiligheidsbril. |
| VN-identificatienummers | Een 1748 |
| HS-code | 2828.10.10 |
| Gevarenklasse | 5.1 (Oxidatiemiddel), 6.1 (giftig) |
| Verpakkingsgroep | II |
| Toxiciteit | LD50 (oraal, rat) – 290 mg/kg; LC50 (inhalatie, rat) – 2,07 mg/l/4 uur; Huidirritatie – Mild; Oogirritatie – Ernstig |
Synthesemethoden voor magnesiumhypochloriet
Om Mg(ClO)2 te synthetiseren is de meest gebruikte methode het laten reageren van magnesiumoxide met chloorgas.
Volgens één methode moet magnesiumoxide in aanwezigheid van water worden gemengd met chloorgas om Mg(ClO)2 te produceren. Zorgvuldige controle is noodzakelijk tijdens de exotherme reactie om de vorming van ongewenste bijproducten te voorkomen.
Een andere methode omvat de reactie tussen magnesiumhydroxide en hypochloorzuur. Om de pH op peil te houden, vindt de reactie gewoonlijk plaats in een natriumhydroxideoplossing. De resulterende Mg(ClO)2-oplossing kan worden afgescheiden door filtratie en vervolgens na de reactie worden gedroogd.
Een derde methode omvat de reactie tussen magnesiumcarbonaat en hypochloorzuur. Bij deze reactie ontstaan Mg(ClO)2 en kooldioxide. Om de vorming van ongewenste bijproducten te voorkomen, is het noodzakelijk om de reactie zorgvuldig te volgen.
Ongeacht de gebruikte synthesemethode is het belangrijk om voorzichtig om te gaan met Mg(ClO)2 vanwege de oxiderende eigenschappen en potentiële gevaren.
Gebruik van magnesiumhypochloriet
Mg(ClO)2 heeft verschillende praktische toepassingen vanwege de oxiderende eigenschappen en het vermogen om chloorgas vrij te geven. Hier zijn enkele veelvoorkomende toepassingen van Mg(ClO)2:
- Waterbehandeling: Vaak gebruikt als desinfectiemiddel in waterzuiveringsinstallaties om schadelijke bacteriën en virussen te doden.
- Bleekmiddel: Gebruikt als bleekmiddel voor textiel, papier en andere materialen.
- Zwembaden: Gebruikt als ontsmettingsmiddel in zwembaden om een goede waterchemie te behouden.
- Geurbestrijding: Wordt gebruikt om onaangename geuren in afvalverwerkingsinstallaties en rioleringen te bestrijden.
- Oxidatiemiddel: gebruikt als oxidatiemiddel bij de productie van verschillende chemicaliën, zoals epoxiden en ketonen.
- Landbouw: Gebruikt in de landbouw als ontsmettingsmiddel en pesticide om schimmel- en bacteriële ziekten te bestrijden.
- Sanitaire voorzieningen: Wordt ook gebruikt als desinfectiemiddel voor oppervlakken en apparatuur in ziekenhuizen, voedselverwerkingsfabrieken en andere faciliteiten.
Vragen:
Vraag: Wat is de formule voor magnesiumhypochloriet?
A: De formule voor magnesiumhypochloriet is Mg(ClO)2.
Vraag: Wat is de pH-waarde van magnesiumhypochloriet?
A: De pH-waarde van Mg(ClO)2 hangt af van de concentratie en kan variëren. Een oplossing van Mg(ClO)2 heeft echter doorgaans een pH tussen 8 en 10.
Vraag: Wat is de molecuulformule van magnesiumhypochloriet?
A: De molecuulformule van magnesiumhypochloriet is Mg(ClO)2.
Vraag: Wat is de naam van Mg(ClO)2?
A: De naam voor Mg(ClO)2 is magnesiumhypochloriet.
Vraag: Is Mg(ClO)2 een zuur of een base?
A: Mg(ClO)2 is een basisch zout en kan in waterige oplossingen als zwakke base fungeren.
Vraag: Is Mg(ClO)2 een zout?
A: Ja, Mg(ClO)2 is zout. Het is een witte kristallijne verbinding die zeer oplosbaar is in water en zowel een metaal (magnesium) als een niet-metaal (chloor) bevat.
