Kaliumhypochloriet (KClO) is een chemische verbinding die vaak wordt gebruikt als desinfectiemiddel en bleekmiddel. Het heeft een sterke geur en kan gevaarlijk zijn als het niet op de juiste manier wordt behandeld.
| IUPAC-naam | Kaliumhypochloriet |
| Moleculaire formule | KClO |
| CAS-nummer | 7778-66-7 |
| Synoniemen | Hypochloorzuur, kaliumzout; Kaliumoxychloride; Kaliumchloraat(I) |
| InChi | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Eigenschappen van kaliumhypochloriet
Kaliumhypochlorietformule
De chemische formule voor kaliumhypochloriet is KClO. Het bestaat uit een kaliumion, een chlooratoom en een zuurstofatoom. Kaliumhypochloriet is bij kamertemperatuur een witte vaste stof en heeft een sterke chloorgeur. Het wordt vaak gebruikt als desinfectiemiddel en bleekmiddel in verschillende industrieën.
Kaliumhypochloriet Molaire massa
De molaire massa van KClO is 90,55 g/mol. Het is de som van de atoommassa’s van de samenstellende elementen kalium, chloor en zuurstof. Molaire massa is een belangrijke parameter die wordt gebruikt bij stoichiometrie en andere chemische berekeningen.
Kookpunt van kaliumhypochloriet
KClO ontleedt voordat het zijn kookpunt bereikt. Het kookpunt is daarom niet goed gedefinieerd. Bij verhitting valt het uiteen in kaliumchloride en zuurstofgas. De ontleding van KClO is een exotherme reactie en kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan.
Kaliumhypochloriet Smeltpunt
Het smeltpunt van KClO is 100 tot 102°C. Het is een witte vaste stof bij kamertemperatuur en smelt bij verhitting. Het smeltpunt is een belangrijke fysische eigenschap van een stof en wordt gebruikt om de stof te identificeren en karakteriseren.
Dichtheid van kaliumhypochloriet g/ml
De dichtheid van KClO is 2,35 g/ml. Dit betekent dat één milliliter KClO 2,35 gram weegt. Dichtheid is een maatstaf voor de massa per volume-eenheid van een stof en is een belangrijke parameter bij chemische berekeningen.
Kaliumhypochloriet Molecuulgewicht
Het molecuulgewicht van KClO is 90,55 g/mol. Het is de som van de atoomgewichten van de samenstellende elementen van een KClO-molecuul. Molecuulgewicht wordt gebruikt bij chemische berekeningen zoals het bepalen van de molmassa en stoichiometrie.
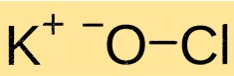
Structuur van kaliumhypochloriet
KClO heeft een kristalstructuur. Het bestaat uit K+-kationen en ClO-anionen die bij elkaar worden gehouden door ionische bindingen. De structuur van KClO is vergelijkbaar met die van andere ionische verbindingen en wordt bepaald door de lading en grootte van de samenstellende ionen.
Oplosbaarheid van kaliumhypochloriet
KClO is zeer oplosbaar in water. Het vormt een oplossing van K+-kationen en ClO-anionen wanneer het in water wordt opgelost. De oplosbaarheid van KClO in water wordt beïnvloed door temperatuur en pH. Hogere temperaturen en lagere pH-waarden verhogen de oplosbaarheid van KClO in water.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 2.35 |
| Kleur | Wit |
| Geur | Sterke geur van chloor |
| Molaire massa | 90,55 g/mol |
| Dikte | 2,35 g/ml |
| Fusie punt | 100-102°C |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Alkalisch (pH 11-13) |
Veiligheid en gevaren van kaliumhypochloriet
KClO kan gevaarlijk zijn als het niet op de juiste manier wordt behandeld. Het is een krachtig oxidatiemiddel dat kan reageren met organische materialen en gevaarlijke verbindingen kan produceren. KClO is ook een krachtig irriterend middel voor de huid, ogen en luchtwegen. Direct contact met de huid kan brandwonden en irritatie veroorzaken. Inademing van KClO-dampen kan hoesten, piepende ademhaling en kortademigheid veroorzaken. Het mengsel moet worden gehanteerd in een goed geventileerde ruimte, met geschikte persoonlijke beschermingsmiddelen zoals handschoenen, een veiligheidsbril en een gasmasker. In geval van accidentele blootstelling moet onmiddellijk medische hulp worden ingeroepen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Draag handschoenen en oog-/gezichtsbescherming. Verwijderd houden van brandbare materialen. Vermijd contact met huid en ogen. |
| VN-identificatienummers | VN1748 |
| HS-code | 2828.90.10 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Kan schadelijk zijn bij inslikken. Veroorzaakt ernstige brandwonden en oogletsel. Kan irritatie van de luchtwegen veroorzaken. |
Methoden voor de synthese van kaliumhypochloriet
Er bestaan verschillende methoden voor het synthetiseren van kaliumhypochloriet.
Een gebruikelijke methode is om chloorgas te laten reageren met een oplossing van kaliumhydroxide . De reactie produceert KClO en kaliumchloride als bijproducten:
Cl2 + 2KOH → KCl + KClO + H2O
Een andere methode omvat de reactie van calciumhypochloriet met kaliumchloride . Deze reactie produceert KClO en calciumchloride als bijproducten:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Om KClO te synthetiseren, kan hypochloorzuur worden gereageerd met kaliumhydroxide .
2 KOH + HOCl → KClO + KCl + H2O
Om KClO te produceren kan elektrolyse worden gebruikt om een elektrische stroom door een oplossing van water en kaliumchloride te laten gaan. De reactie produceert KClO, waterstofgas en kaliumhydroxide als bijproducten:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Het gesynthetiseerde KClO moet op een koele, droge plaats worden bewaard, uit de buurt van direct zonlicht en hitte.
Gebruik van kaliumhypochloriet
KClO heeft verschillende toepassingen in verschillende industrieën en toepassingen. Hier zijn enkele veelvoorkomende toepassingen:
- Waterbehandeling: Gebruikt als ontsmettingsmiddel in waterzuiveringsinstallaties om bacteriën en andere schadelijke organismen te doden.
- Bleekmiddel: Gebruikt als bleekmiddel in de textielindustrie om stoffen witter te maken.
- Desinfectiemiddel: Gebruikt als desinfectiemiddel in de voedingsindustrie om oppervlakken en apparatuur die in contact komen met voedsel te desinfecteren.
- Zwembadonderhoud: Gebruikt als ontsmettingsmiddel en algicide in zwembaden om het water schoon en helder te houden.
- Sterilisatie: Gebruikt voor sterilisatie in medische omgevingen en laboratoria om apparatuur en oppervlakken te desinfecteren.
- Deodorant: Gebruikt als deodorant in rioolwaterzuiveringsinstallaties om onaangename geuren te neutraliseren.
- Pulp- en papierindustrie: Gebruikt in de pulp- en papierindustrie als bleekmiddel voor papierproducten.
- Landbouw: Wordt in de landbouw gebruikt als pesticide en fungicide om gewassen te beschermen tegen ziekten en plagen.
- Desinfectiemiddel: Gebruikt als desinfectiemiddel in huishoudelijke schoonmaakproducten om ziektekiemen en bacteriën te doden.
- Olie- en gasindustrie: Gebruikt in de olie- en gasindustrie om oliebronnen en pijpleidingen te behandelen om bacteriën onder controle te houden en corrosie te voorkomen.
Vragen:
Vraag: Wat is kaliumhypochloriet?
A: Kaliumhypochloriet is een chemische verbinding met de formule KClO, die vaak wordt gebruikt als ontsmettingsmiddel, bleekmiddel en chemische stof voor waterbehandeling.
Vraag: Wat is de pH van een 0,42 M KClO-oplossing? [Ka(HClO) = 4,0 × 10–8]
A: De pH van een 0,42 M oplossing van KClO kan worden berekend met behulp van de Ka-waarde van het geconjugeerde zuur, HClO. De pH ligt rond de 12,69.
Vraag: Wat zijn natriumhypochloriet en kaliumhydroxide?
A: Natriumhypochloriet is een chemische verbinding met de formule NaClO, die vaak wordt gebruikt als bleekmiddel en ontsmettingsmiddel. Kaliumhydroxide is een chemische verbinding met de formule KOH, die vaak wordt gebruikt bij de zeepproductie en als laboratoriumreagens.
Vraag: Wat is de pH van een 0,116 M waterige oplossing van KClO?
A: De pH van een 0,116 M waterige oplossing van KClO kan worden berekend met behulp van de Kb-waarde van de geconjugeerde base, ClO-. De pH ligt rond de 11,31.
Vraag: Wat is de pH van een 0,191 M waterige oplossing van KClO?
A: De pH van een 0,191 M waterige oplossing van KClO kan worden berekend met behulp van de Kb-waarde van de geconjugeerde base, ClO-. De pH ligt rond de 11,92.
Vraag: Is KClO oplosbaar?
A: Ja, KClO is oplosbaar in water en vormt een alkalische oplossing.
Vraag: Kan ik natriumhypochloriet en kaliumhypochloriet mengen?
A: Het mengen van natriumhypochloriet en KClO wordt niet aanbevolen, omdat dit een chemische reactie kan veroorzaken waarbij warmte, gassen en mogelijk schadelijke bijproducten ontstaan.
