Kaliumbisulfiet is een chemische verbinding. Het heeft de formule KHSO3. Het werkt als conserveermiddel en antioxidant in voedsel en wijn.
| Naam van IUPAC | Kaliumwaterstofsulfiet |
| Moleculaire formule | KHSO3 |
| CAS-nummer | 7773-03-7 |
| Synoniemen | Kaliumbisulfiet, kaliumbisulfiet, monokaliumzout, monokaliumsulfiet, kaliumhydrosulfiet |
| InChi | InChI=1S/K.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
Eigenschappen van kaliumbisulfiet
Kaliumbisulfietformule
De formule voor kaliumbisulfiet is KHSO3. Deze formule toont de verhouding van kalium-, waterstof-, zwavel- en zuurstofatomen in één eenheid kaliumbisulfiet. De formule kan ook worden geschreven als KH(SO3), wat aangeeft dat kaliumbisulfiet een zout is van kalium en zwavelzuur (H2SO3).
Kaliumbisulfiet molaire massa
De molaire massa van kaliumbisulfiet is 120,1694 g/mol. Dit betekent dat één mol kaliumbisulfiet een massa heeft van 120,1694 gram. De molaire massa wordt berekend door de atoommassa’s van kalium, waterstof, zwavel en zuurstof in de formule KHSO3 op te tellen.
Kookpunt van kaliumbisulfiet
KHSO3 heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het het kookpunt bereikt. Bij verhitting boven 190°C valt KHSO3 uiteen in kaliummetabisulfiet en water. De ontledingsreactie is endotherm, wat betekent dat het warmte uit de omgeving absorbeert.
Kaliumbisulfiet smeltpunt
KHSO3 heeft een smeltpunt van 190°C, dezelfde temperatuur waarbij het ontleedt. Daarom bestaat KHSO3 onder normale omstandigheden niet in vloeibare vorm. Het is een witte kristallijne vaste stof die oplost in water.
Kaliumbisulfiet Dichtheid g/ml
De dichtheid van KHSO3 is 2,103 g/ml bij 20°C. Dit betekent dat één milliliter KHSO3 een massa heeft van 2,103 gram. De dichtheid wordt beïnvloed door de temperatuur en concentratie van de oplossing.
Kaliumbisulfiet Molecuulgewicht
Het molecuulgewicht van KHSO3 is hetzelfde als de molaire massa, namelijk 120,1694 g/mol. Het molecuulgewicht is de massa van een KHSO3-molecuul, die erg klein is en niet direct kan worden gemeten. Het molecuulgewicht is nuttig voor het berekenen van het aantal moleculen in een bepaalde massa of volume van een stof.
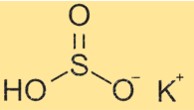
Structuur van kaliumbisulfiet
KHSO3 heeft een structuur die is samengesteld uit K+- en HSO3–ionen. Het bisulfietion heeft een tetraëdrische vorm met één waterstofatoom en drie zuurstofatomen gebonden aan een centraal zwavelatoom. Het zwavelatoom heeft een dubbele binding met één zuurstofatoom en een enkele binding met de andere twee zuurstofatomen. Het waterstofatoom is gebonden aan een van de enkelvoudig gebonden zuurstofatomen.
Oplosbaarheid van kaliumbisulfiet
KHSO3 is een chemisch mengsel dat in water oplost en kaliumionen en bisulfietionen vormt. Het heeft een zwavelachtige geur en een wit, vast uiterlijk. Het is oplosbaar in water, met een oplosbaarheid van 49 g/100 ml bij 20°C. Het wordt gebruikt als sterilisatiemiddel bij de productie van alcoholische dranken.
| Verschijning | Wit kristallijn poeder |
| Specifieke dichtheid | 2.103 |
| Kleur | Wit |
| Geur | typisch SO2 |
| Molaire massa | 120,1694 g/mol |
| Dikte | 2,103 g/ml bij 20°C |
| Fusie punt | 190°C (ontleedt) |
| Kookpunt | N.v.t. (ontbonden) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | 49 g/100 ml bij 20°C |
| Oplosbaarheid | Onoplosbaar in alcohol |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | 6,97 bij 25°C |
| pH | 4,5 (0,1M oplossing) |
Kaliumbisulfiet Veiligheid en gevaren
KHSO3 is een bijtende stof die ernstige brandwonden en oogletsel kan veroorzaken. Het kan ook irritatie van de luchtwegen en brandwonden aan het spijsverteringskanaal veroorzaken als het wordt ingeademd of ingeslikt. Het is gevoelig voor vocht en geeft bij reactie met zuren giftig zwaveldioxide af. Er moet voorzichtig mee worden omgegaan en met de juiste persoonlijke beschermingsmiddelen. Het moet worden opgeslagen in een droge, goed geventileerde ruimte, uit de buurt van hitte, vonken, vlammen en onverenigbare materialen. Het moet worden weggegooid in overeenstemming met de plaatselijke regelgeving. Bij blootstelling dient u onmiddellijk medische hulp in te roepen en de eerstehulpmaatregelen te volgen die op het veiligheidsinformatieblad staan aangegeven.
| Gevarensymbolen | C (corrosief) |
| Beveiligingsbeschrijving | S26: Bij aanraking met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. S45: Bij een ongeval of als u zich onwel voelt, dient u onmiddellijk een arts te raadplegen (indien mogelijk het etiket tonen). |
| VN-identificatienummers | VN 3260 |
| HS-code | 2832 10 00 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Orale LD50 (rat): 2340 mg/kg |
Synthesemethoden voor kaliumbisulfiet
Hier zijn enkele methoden om KHSO3 te synthetiseren:
- Eén methode omvat het reageren met zwaveldioxide en kaliumcarbonaat in een oplossing. Om KHSO3-kristallen te verkrijgen, laat u zwaveldioxide door de oplossing lopen totdat er geen kooldioxide meer vrijkomt, en concentreert u vervolgens de oplossing.
- Een andere methode omvat het reageren met kaliumchloride en zwavelzuur in een oplossing. Bij de reactie ontstaan waterstofchloride en KHSO3. Na afkoelen ondergaat de oplossing actief filtratie om het vaste KHSO3 af te scheiden.
- Een derde methode omvat het reageren met kaliumhydroxide en zwavelzuur in een oplossing. De reactie produceert water en KHSO3. Om het KHSO3 te zuiveren kan de oplossing worden herkristalliseerd.
Gebruik van kaliumbisulfiet
Hier zijn enkele toepassingen van KHSO3:
- Sterilisatiemiddel: gebruikt als sterilisatiemiddel bij de productie van alcoholische dranken. Het voorkomt de groei van bacteriën en schimmels die wijn of bier kunnen bederven.
- Conserveermiddel: Gebruikt als conserveermiddel en antioxidant in voedingsmiddelen. Het remt het bruin worden en de oxidatie van fruit, groenten, sappen, sauzen en gedroogd voedsel.
- Reductiemiddel: Gebruikt als reductiemiddel in de organische chemie. Het kan aldehyden, ketonen, nitrogroepen, sulfonen en sulfoxiden reduceren tot hun overeenkomstige alcoholen, aminen, sulfiden en sulfiden.
- Bleekmiddel: Gebruikt als bleekmiddel in de textiel- en papierindustrie. Het kan kleur en vlekken uit weefsels en pulp verwijderen.
- Gebruikt als bron van zwaveldioxide in verschillende toepassingen. Bij verhitting of vermenging met zuren kan zwaveldioxide vrijkomen. Zwaveldioxide is een ontsmettingsmiddel, desinfectiemiddel, oplosmiddel en katalysator.
Vragen:
Vraag: Hoeveel kaliumbisulfiet moet worden gedesinfecteerd?
A: De hoeveelheid KHSO3 die nodig is voor desinfectie hangt af van de concentratie van de oplossing en de specifieke beoogde micro-organismen. Het wordt aanbevolen om de instructies op het productetiket te volgen of advies in te winnen bij een gekwalificeerde professional.
Vraag: Wat is de formule voor kaliumbisulfiet?
A: De chemische formule voor kaliumbisulfiet is KHSO3.
Vraag: Is kaliumbisulfiet veilig?
A: KHSO3 is over het algemeen veilig als het volgens de aanwijzingen wordt gebruikt. Het kan echter irriterend zijn voor de huid, ogen en luchtwegen. Het kan bij sommige mensen ook allergische reacties veroorzaken. Het is belangrijk om KHSO3 op de juiste manier te hanteren en op te slaan en indien nodig beschermende uitrusting te gebruiken.
Vraag: Hoe lang is kaliumbisulfiet goed?
A: De houdbaarheid van KHSO3 is afhankelijk van verschillende factoren zoals bewaaromstandigheden, concentratie en zuiverheid van het product. Over het algemeen kan het meerdere jaren meegaan als het op een koele, droge plaats in een goed gesloten verpakking wordt bewaard.
Vraag: Hoe reageren NaHSO3 en kaliumjodaat om een jodiumreactie te veroorzaken met zetmeelvergelijkingen?
A: De reactie van NaHSO3 en kaliumjodaat produceert jodium, dat vervolgens kan reageren met zetmeel om een blauwzwart complex te vormen. De reactievergelijkingen zijn: 5NaHSO3 + KIO3 → 5NaHSO4 + KI + 3H2O + I2 I2 + zetmeel → blauwzwartcomplex
