Kaliumsulfiet (K2SO3) is een chemische verbinding bestaande uit kalium, zwavel en zuurstof. Het wordt vaak gebruikt als conserveermiddel in de voedingsindustrie om verkleuring en bederf te voorkomen.
| IUPAC-naam | Kaliumsulfiet |
| Moleculaire formule | K2SO3 |
| CAS-nummer | 10117-38-1 |
| Synoniemen | Dikaliumsulfiet; Dikaliumzout van zwavelig zuur; Kaliumsulfonaat; Zwavel- en kaliumoxide |
| InChi | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Kaliumsulfiet
Kaliumsulfietformule
Kaliumsulfiet heeft de chemische formule K2SO3, wat aangeeft dat het twee kaliumatomen, één zwavelatoom en drie zuurstofatomen bevat. De verbinding wordt gevormd door de reactie tussen kaliumhydroxide (KOH) en zwaveldioxide (SO2). Kaliumsulfiet is een ionische verbinding, wat betekent dat het bestaat uit positief geladen kaliumionen en negatief geladen sulfietionen. De formule voor het sulfietion is SO32-.
Kaliumsulfiet molaire massa
De molmassa van K2SO3 bedraagt 158,26 g/mol. Dit wordt berekend door de atoommassa’s van elk element in de formule (2 x atoommassa van K) + atoommassa van S + (3 x atoommassa van O) op te tellen. De molmassa van een verbinding is belangrijk omdat deze helpt bij het berekenen van de hoeveelheid verbinding die nodig is voor een bepaalde reactie of bij het bepalen van de concentratie van een oplossing.
Kookpunt van kaliumsulfiet
K2SO3 heeft geen specifiek kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting ondergaat K2SO3 echter thermische ontleding en vormt kaliumsulfaat (K2SO4) en zwaveldioxide (SO2). De ontledingstemperatuur bedraagt ongeveer 390°C.
Kaliumsulfiet smeltpunt
Het smeltpunt van K2SO3 ligt rond de 350°C. Bij deze temperatuur verandert de vaste verbinding in een vloeistof. Naarmate de temperatuur stijgt, valt K2SO3 echter uiteen, zoals eerder vermeld.
Dichtheid van kaliumsulfiet g/ml
De dichtheid van K2SO3 is 2,44 g/ml bij kamertemperatuur. Dichtheid wordt gedefinieerd als de massa van een stof per volume-eenheid. De hoge dichtheid van K2SO3 geeft aan dat het een relatief zware verbinding is. Deze eigenschap is belangrijk bij het bepalen van de fysische eigenschappen van de verbinding, zoals de oplosbaarheid en reactiviteit ervan.
Kaliumsulfiet Molecuulgewicht
Het molecuulgewicht van K2SO3 bedraagt 158,26 g/mol. Deze waarde vertegenwoordigt de gemiddelde massa van een molecuul van de verbinding. Het molecuulgewicht is belangrijk voor het berekenen van de hoeveelheid van een stof in een bepaald volume of een bepaalde massa, wat handig is bij chemische reacties en laboratoriumexperimenten.
Structuur van kaliumsulfiet
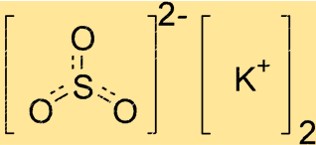
K2SO3 heeft een kristalstructuur, wat betekent dat de atomen in een zich herhalend patroon zijn gerangschikt. De verbinding heeft een trigonale vlakke geometrie, met het zwavelatoom in het midden en de drie zuurstofatomen symmetrisch daaromheen gerangschikt. Kaliumionen bevinden zich buiten deze structuur en balanceren de negatieve lading van de sulfietionen.
Oplosbaarheid van kaliumsulfiet
K2SO3 is zeer goed oplosbaar in water. Bij kamertemperatuur kan het in water oplossen en een heldere, kleurloze oplossing vormen. De oplosbaarheid van K2SO3 is te danken aan zijn ionische aard, waardoor het in water kan dissociëren in de samenstellende ionen. De oplosbaarheid van K2SO3 wordt ook beïnvloed door de temperatuur, waarbij de oplosbaarheid toeneemt naarmate de temperatuur stijgt.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 2.44 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 158,26 g/mol |
| Dikte | 2,44 g/ml |
| Fusie punt | 350°C |
| Kookpunt | Ontleedt bij 390°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol en glycerol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 10.3 (voor zwaveligzuur) |
| pH | ~9 (voor een oplossing van 0,1 M) |
Kaliumsulfiet Veiligheid en gevaren
K2SO3 is relatief veilig te hanteren en te gebruiken als de juiste voorzorgsmaatregelen worden genomen. Het kan echter gevaren opleveren als er niet zorgvuldig mee wordt omgegaan. De verbinding kan irritatie aan de huid, ogen en luchtwegen veroorzaken als deze in contact komt met deze delen van het lichaam. K2SO3 kan bij inname ook maag-darmproblemen veroorzaken. Bovendien vormt de verbinding een potentieel brand- en explosiegevaar bij blootstelling aan hitte of vlammen. Daarom moeten passende veiligheidsmaatregelen worden genomen bij het werken met K2SO3, zoals het dragen van beschermende uitrusting en het opslaan van de verbinding uit de buurt van hitte en ontstekingsbronnen.
| Gevarensymbolen | Schedel en gekruiste knekels |
| Beveiligingsbeschrijving | Giftig, schadelijk bij inslikken, irriterend voor huid en ogen |
| VN-identificatienummers | VN 2697 |
| HS-code | 283210 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Oraal (LD50): 345 mg/kg (rat) |
Synthesemethoden voor kaliumsulfiet
K2SO3 kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van kaliumhydroxide met zwaveldioxide of zwavel, de reactie van kaliumcarbonaat met zwaveldioxide en de reactie van kaliumbisulfiet met hydroxide. potassium.
Bij de eerste methode reageert een oplossing van kaliumhydroxide met zwaveldioxidegas in aanwezigheid van water om K2SO3 te vormen. Bij de tweede methode wordt een mengsel van kaliumcarbonaat en zwaveldioxide tot hoge temperaturen verwarmd om K2SO3 te produceren. De derde methode omvat het mengen van kaliumbisulfiet met kaliumhydroxide om K2SO3 en water te produceren.
Een andere gebruikelijke methode om K2SO3 te synthetiseren is de reactie van zwaveldioxide met een kaliumzout, zoals kaliumchloride, in aanwezigheid van reductiemiddelen zoals natriumhydrosulfiet of ijzer(II)sulfaat. Deze methode wordt vaak gebruikt in industriële omgevingen om grote hoeveelheden K2SO3 te produceren.
Gebruik van kaliumsulfiet
K2SO3 heeft vanwege zijn chemische eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele veelvoorkomende toepassingen van K2SO3:
- Voedings- en drankenindustrie: gebruikt als voedselconserveermiddel om bederf en verkleuring van voedingsmiddelen zoals wijn, gedroogd fruit en garnalen te voorkomen.
- Fotografie: Gebruikt als fotografisch fixeermiddel om verdere ontwikkeling van de film te voorkomen en het beeld permanent te maken.
- Waterbehandeling: Gebruikt als reductiemiddel om chloor uit water te verwijderen en afvalwater te behandelen.
- Papierindustrie: Gebruikt als bleekmiddel om onzuiverheden te verwijderen en de pulp witter te maken tijdens het papierproductieproces.
- Textielindustrie: Gebruikt als reductiemiddel om overtollige kleurstof uit stoffen te verwijderen en textiel witter te maken.
- Chemische industrie: gebruikt als reductiemiddel bij chemische reacties om oxidatiemiddelen om te zetten in reductiemiddelen.
- Medicinale industrie: Gebruikt bij sommige medische behandelingen om de symptomen van bepaalde aandoeningen te voorkomen of te verlichten.
Vragen:
Vraag: Wat is de formule voor kaliumsulfiet?
A: De formule voor kaliumsulfiet is K2SO3.
Vraag: Is kaliumsulfaat een sulfiet?
A: Nee, kaliumsulfaat is geen sulfiet. Het is een zout bestaande uit kalium, zwavel en zuurstof met de chemische formule K2SO4.
Vraag: Welk zout ontstaat er als H2SO4 reageert met NaOH? K2SO3, Na2SO4, Na2SO3, K2SO4
A: Wanneer H2SO4 reageert met NaOH, is het geproduceerde zout Na2SO4.
Vraag: Hoeveel SO32-ionen zitten er in 99,6 mg Na2SO3?
De molmassa van Na2SO3 bedraagt 126,05 g/mol. A: Om het aantal SO32-ionen te berekenen, moeten we eerst het aantal mol Na2SO3 vinden: 99,6 mg / 126,05 g/mol = 0,000789 mol. Omdat Na2SO3 twee SO32-ionen per molecuul bevat, is het aantal SO32-ionen in 0,000789 mol Na2SO3 0,000789 mol x 2 = 0,00158 mol. Er zitten dus 0,00158 mol x 6,022 x 10^23 ionen/mol = 9,52 x 10^20 SO32-ionen in 99,6 mg Na2SO3.
Vraag: Hoeveel natriumionen zitten er in 99,6 mg Na2SO3? De molmassa van Na2SO3 bedraagt 126,05 g/mol.
A: Om het aantal natriumionen te berekenen, moeten we eerst het aantal mol Na2SO3 vinden: 99,6 mg / 126,05 g/mol = 0,000789 mol. Omdat elk molecuul Na2SO3 twee natriumionen bevat, is het aantal natriumionen in 0,000789 mol Na2SO3 0,000789 mol x 2 = 0,00158 mol. Daarom zijn er 0,00158 mol x 6,022 x 10^23 ionen/mol = 9,52 x 10^20 natriumionen in 99,6 mg Na2SO3.
Vraag: Wat is de chemische naam voor Na2SO3?
A: De chemische naam voor Na2SO3 is natriumsulfiet.
Vraag: Wat is de naam van de verbinding met de formule Na2SO3?
A: De naam van de verbinding met de formule Na2SO3 is natriumsulfiet.
