Magnesiumsulfiet (MgSO3) is een verbinding bestaande uit magnesium- en sulfietionen. Het wordt vaak gebruikt als conserveermiddel en antioxidant in de voedingsindustrie.
| IUPAC-naam | Magnesiumsulfiet |
| Moleculaire formule | MgSO3 |
| CAS-nummer | 7757-88-2 |
| Synoniemen | Magnesiumsulfonaat, magnesiumzwaveltrioxide, E-536 |
| InChi | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschappen van magnesiumsulfiet
Magnesiumsulfietformule
Magnesiumsulfiet heeft de chemische formule MgSO3, wat aangeeft dat het bestaat uit één magnesiumatoom, één zwavelatoom en drie zuurstofatomen. Het sulfietion is een polyatomair ion met de formule SO3 2-, bestaande uit een centraal zwavelatoom gebonden aan drie zuurstofatomen. Het Mg-ion heeft een lading van +2, terwijl het SO3 2-ion een lading heeft van -2, waardoor de verbinding elektrisch neutraal is.
Magnesiumsulfiet Molaire massa
De molaire massa van MgSO3 is 104,37 g/mol, wat overeenkomt met de som van de atoommassa’s van één magnesiumatoom, één zwavelatoom en drie zuurstofatomen. Deze waarde is belangrijk voor het berekenen van de hoeveelheid MgSO3 die nodig is voor een bepaalde reactie, en voor het bepalen van de stoichiometrie van chemische vergelijkingen.
Kookpunt van magnesiumsulfiet
MgSO3 ontleedt voordat het zijn kookpunt bereikt en heeft dus geen specifiek kookpunt. In plaats daarvan begint het bij temperaturen boven de 700°C uiteen te vallen in magnesiumoxide en zwaveldioxide. Dit afbraakproces kan worden versneld door blootstelling aan lucht of vocht, waardoor MgSO3 een relatief onstabiele verbinding wordt.
Magnesiumsulfiet Smeltpunt
Het smeltpunt van MgSO3 is ongeveer 150°C. Bij deze temperatuur begint de verbinding te ontleden in magnesiumoxide en zwaveldioxide. Het ontbindingsproces is exotherm, wat betekent dat er warmte vrijkomt. Het smeltpunt van MgSO3 is belangrijk voor het begrijpen van de eigenschappen ervan als vaste stof, zoals de oplosbaarheid en kristalstructuur.
Dichtheid van magnesiumsulfiet g/ml
De dichtheid van MgSO3 varieert afhankelijk van de fysieke vorm, maar varieert over het algemeen van 2,5 tot 3,0 g/ml. Deze waarde is belangrijk voor het bepalen van de massa van een bepaald volume MgSO3, maar ook voor het begrijpen van het gedrag ervan in oplossing. De dichtheid van MgSO3 kan ook worden gebruikt om de dichtheid ervan te berekenen, wat een maat is voor de relatieve dichtheid ervan in vergelijking met water.
Magnesiumsulfiet Molecuulgewicht
Het molecuulgewicht van MgS03 bedraagt 104,37 g/mol. Deze waarde is belangrijk voor het begrijpen van de fysische en chemische eigenschappen van de verbinding, maar ook voor het berekenen van de hoeveelheid MgSO3 die nodig is voor een bepaalde reactie. Het molecuulgewicht van MgSO3 kan worden berekend door de atoomgewichten van één magnesiumatoom, één zwavelatoom en drie zuurstofatomen op te tellen.
Structuur van magnesiumsulfiet
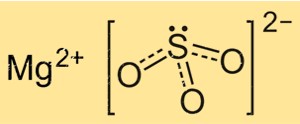
De structuur van MgSO3 is gebaseerd op een kristalrooster van Mg+2-ionen en SO3 2-ionen. De Mg+2-ionen zijn omgeven door zes zuurstofatomen, octaëdrisch gerangschikt, terwijl de SO3 2–ionen via twee zuurstofatomen aan de magnesiumionen zijn gekoppeld. De kristalstructuur van MgSO3 is belangrijk voor het begrijpen van de fysische en chemische eigenschappen ervan, zoals de oplosbaarheid en reactiviteit.
Oplosbaarheid van magnesiumsulfiet
MgSO3 is slecht oplosbaar in water, met een oplosbaarheid van ongeveer 7,5 g/L bij kamertemperatuur. Deze lage oplosbaarheid is te wijten aan de kristalstructuur van de verbinding, waardoor het voor watermoleculen moeilijk is om in de vaste stof binnen te dringen en op te lossen. MgSO3 is beter oplosbaar in zure oplossingen omdat het zuur kan reageren met het sulfietion om bisulfiet en zwavelig zuur te vormen. De oplosbaarheid van MgSO3 is belangrijk voor het begrijpen van het gedrag ervan in oplossing, en voor het bepalen van de effectiviteit ervan als voedselconserveermiddel en antioxidant.
| Verschijning | Wit poeder of kristallen |
| Soortelijk gewicht | 2,5 – 3,0 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 104,37 g/mol |
| Dikte | 2,5 tot 3,0 g/ml |
| Fusie punt | Rond de 150°C |
| Kookpunt | Ontleedt boven 700°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Enigszins oplosbaar, ongeveer 7,5 g/l bij kamertemperatuur |
| Oplosbaarheid | Beter oplosbaar in zure oplossingen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van magnesiumsulfiet
MgSO3 wordt niet als een zeer gevaarlijke stof beschouwd. Het kan echter bij contact of inademing irritatie aan de ogen, de huid en de luchtwegen veroorzaken. Inslikken van MgSO3 kan maag-darmirritatie en mogelijk braken veroorzaken. Langdurige blootstelling aan hoge concentraties kan leiden tot longschade of irritatie van de luchtwegen. Het is daarom belangrijk om voorzichtig met MgSO3 om te gaan, de juiste persoonlijke beschermingsmiddelen te dragen en het inademen van stof of dampen te vermijden. MgSO3 moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen zoals sterke oxidatiemiddelen, zuren en basen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd inademing van stof of dampen. Draag geschikte persoonlijke beschermingsmiddelen. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2833.29 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit, kan irritatie aan ogen, huid en luchtwegen veroorzaken bij contact of inademing. Inslikken kan maag-darmirritatie en mogelijk braken veroorzaken. Langdurige blootstelling aan hoge concentraties kan leiden tot longschade of irritatie van de luchtwegen. |
Methoden voor synthese van magnesiumsulfiet
MgSO3 kan op verschillende manieren worden gesynthetiseerd, zoals de reactie van zwavelzuur of zwaveldioxidegas met magnesiumoxide of magnesiumhydroxide.
Bij één methode vormt de reactie van magnesiumoxide met water magnesiumhydroxide , dat vervolgens reageert met zwavelzuur om MgSO3 te produceren.
Een andere methode omvat het laten reageren van magnesiumhydroxide met zwaveldioxidegas in aanwezigheid van water om MgSO3 te vormen.
Bij een andere methode kan het reageren van magnesiumsulfaat met natriumsulfiet of kaliumsulfiet MgSO3 synthetiseren. Deze reactie produceert een neerslag van MgSO3, dat onderzoekers kunnen isoleren door filtratie en drogen.
Door de reactie van magnesiumacetaat met zwaveldioxidegas in aanwezigheid van water kan MgSO3 ontstaan. Was en droog vervolgens het resulterende MgS03-neerslag.
Deze methoden kunnen worden gebruikt om MgSO3 te produceren voor een verscheidenheid aan toepassingen, waaronder de productie van papier en pulp, de verwerking van voedsel en dranken en waterbehandeling.
Gebruik van magnesiumsulfiet
MgSO3 heeft verschillende toepassingen in verschillende industrieën. Hier zijn enkele van de meest voorkomende toepassingen:
- Waterbehandeling: Gebruikt als zuurstofvanger bij de behandeling van ketelwater om corrosie en kalkvorming te voorkomen.
- Voedsel- en drankverwerking: Gebruikt als conserveermiddel en antioxidant bij de voedsel- en drankverwerking om de houdbaarheid te verlengen en bederf te voorkomen.
- Pulp- en papierproductie: Gebruikt als bleekmiddel in de pulp- en papierindustrie om de helderheid en kleur van papierproducten te verbeteren.
- Textielproductie: Gebruikt als reductiemiddel bij de textielproductie om overtollige zuurstof te verwijderen en de kwaliteit van het eindproduct te verbeteren.
- Landbouw: Gebruikt als bladspray om de plantengroei te verbeteren en de gewasopbrengsten te verhogen.
- Geneeskunde: Gebruikt in de traditionele geneeskunde vanwege de antioxiderende en ontstekingsremmende eigenschappen.
- Cosmetica: Gebruikt in cosmetica als emulgator, stabilisator en pH-regelaar.
- Andere toepassingen: Wordt ook gebruikt bij de productie van lijmen, verven en coatings, evenals bij afvalwaterzuiveringsprocessen.
Vragen:
Vraag: Wat is de formule voor magnesiumsulfiet?
A: De formule voor magnesiumsulfiet is MgSO3.
Vraag: Hoeveel magnesiumsulfiet zit er in een monster van 2,4 mol?
A: In een monster van 2,4 mol MgSO3 zitten 2,4 mol MgSO3.
Vraag: Wat is het massapercentage van elk element in 1 mol magnesiumsulfiet?
A: In één mol magnesiumsulfiet is het massapercentage magnesium 32,44%, zwavel 29,44% en zuurstof 38,12%.
Vraag: Stopt magnesiumsulfiet spierkrampen?
A: Er is geen wetenschappelijk bewijs dat suggereert dat MgSO3 spierkrampen kan stoppen. Voor dit doel is echter magnesiumsulfaat (Epsom-zout) gebruikt.
Vraag: Wat is het effect van het toevoegen van magnesiumsulfiet aan de reacties?
A: De toevoeging van MgSO3 kan bij bepaalde reacties als reductiemiddel werken door zuurstof te verwijderen. Het kan bij bepaalde toepassingen ook fungeren als conserveermiddel en antioxidant.
Vraag: Is magnesiumsulfiet ionisch of moleculair?
A: MgSO3 is een ionische verbinding.
