Calciumhydroxide (Ca(OH)2) is een chemische verbinding die wordt gebruikt in verschillende toepassingen, zoals de voedselproductie, waterbehandeling en de bouw. Het wordt gemaakt door calciumoxide met water te mengen en heeft een wit, poederachtig uiterlijk.
| Naam van IUPAC | Calcium hydroxide |
| Moleculaire formule | Ca(OH)2 |
| CAS-nummer | 1305-62-0 |
| Synoniemen | Gebluste kalk, gehydrateerde kalk, limoenmelk, ingelegde limoen |
| InChi | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Eigenschappen van calciumhydroxide
Calciumhydroxide-formule
De chemische formule voor calciumhydroxide is Ca(OH)2. Dit betekent dat elk molecuul calciumhydroxide één Ca2+-ion en twee OH-ionen bevat. De formule is belangrijk in de scheikunde omdat deze het aantal en de soorten atomen in een verbinding vertegenwoordigt.
Molaire massa calciumhydroxide
Ca(OH)2 heeft een molaire massa van 74,09 g/mol. Het bestaat uit één calciumatoom, twee zuurstofatomen en twee waterstofatomen. Molaire massa is een belangrijke eigenschap in de scheikunde, omdat deze wordt gebruikt om de hoeveelheid van een stof in een bepaald monster te berekenen.
Kookpunt van calciumhydroxide
Ca(OH)2 heeft een zeer hoog kookpunt van 2400°C. Dit betekent dat er een aanzienlijke hoeveelheid warmte nodig is om het van een vloeistof in een gas te veranderen. Het hoge kookpunt is te wijten aan de sterke ionische bindingen tussen de calcium- en hydroxide-ionen.
Smeltpunt van calciumhydroxide
Ca(OH)2 heeft een relatief laag smeltpunt van 580°C. Dit betekent dat het gemakkelijk kan worden gesmolten en in verschillende vormen kan worden gegoten. Het lage smeltpunt is te wijten aan de ionische aard van de verbinding, waardoor de ionen vrijer kunnen bewegen bij verhitting.
Dichtheid van calciumhydroxide g/ml
De dichtheid van Ca(OH)2 is 2,24 g/ml. Dit betekent dat het een relatief zware verbinding is, vergeleken met water dat een dichtheid van 1 g/ml heeft. De hoge dichtheid is te danken aan het zeer compacte karakter van de Ca2+- en OH–ionen.
Calciumhydroxide Molecuulgewicht
Het molecuulgewicht van Ca(OH)2 bedraagt 74,09 g/mol. Dit is de som van de atoomgewichten van de calcium-, zuurstof- en waterstofatomen in de verbinding. Molecuulgewicht is een belangrijke eigenschap in de chemie, omdat het wordt gebruikt om verschillende parameters te berekenen, zoals molariteit en samenstellingspercentage.
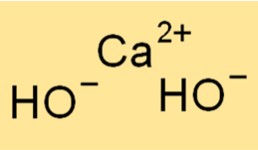
Structuur van calciumhydroxide
Ca(OH)2 heeft een kristalstructuur, waarbij elk calciumion omgeven is door zes hydroxide-ionen in een octaëdrische opstelling. Deze structuur geeft de compound zijn karakteristieke witte en poederachtige uiterlijk. De ionische bindingen tussen de Ca2+- en OH–ionen zijn sterk, waardoor de verbinding zijn hoge smelt- en kookpunten krijgt.
| Verschijning | wit poeder |
| Soortelijk gewicht | 2,24 g/cm³ |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 74,09 g/mol |
| Dikte | 2,24 g/cm³ |
| Fusie punt | 580°C |
| Kookpunt | 2.400°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 1,7 g/l (20°C) |
| Oplosbaarheid | Oplosbaar in zuren |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 12.5 (eerste dissociatie) |
| pH | 12,5 (0,1 M oplossing, 25°C) |
Veiligheid en gevaren van calciumhydroxide
Ca(OH)2 wordt over het algemeen als veilig beschouwd als het op de juiste manier wordt behandeld. Het kan echter schadelijk zijn als het wordt ingeslikt, ingeademd of als het in contact komt met de huid of ogen. Dit kan irritatie, brandwonden en ademhalingsproblemen veroorzaken. Stof uit de verbinding kan ook de luchtwegen irriteren. Bij het hanteren van Ca(OH)2 moeten beschermende uitrusting zoals handschoenen, een veiligheidsbril en een ademhalingstoestel worden gedragen. De verbinding moet ook worden bewaard in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen. In geval van contact of inslikken, onmiddellijk medische hulp inroepen.
| Gevarensymbolen | Xi (irriterend) |
| Beveiligingsbeschrijving | Draag beschermende handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | Een 1910 |
| HS-code | 2825.90.90 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | III |
| Toxiciteit | Calciumhydroxide wordt over het algemeen als niet-giftig beschouwd als het op de juiste manier wordt behandeld. Inslikken of inademen kan echter de luchtwegen en het spijsverteringskanaal irriteren en verbranden. |
Methoden voor de synthese van calciumhydroxide
Er zijn verschillende methoden om Ca(OH)2 te synthetiseren.
Een gebruikelijke methode voor het synthetiseren van Ca(OH)2 is het laten reageren van water met calciumoxide , wat resulteert in de vorming van gebluste kalk of gehydrateerde kalk.
Een andere methode omvat de reactie van calciumchloride met natriumhydroxide. Bij de reactie van water en koolstofdioxide met calciumcarbonaat ontstaat Ca(OH)2.
Het hydratatieproces omvat het mengen van water met calciumoxide met behulp van de gebluste kalkmethode. Deze reactie produceert Ca(OH)2 en warmte als bijproduct. Het proces verwijdert verder onzuiverheden en overtollig water uit de resulterende pasta.
De calciumchloridemethode omvat het mengen van calciumchloride en natriumhydroxide in een proces dat dubbele ontleding wordt genoemd.
Deze reactie produceert Ca(OH)2 en natriumchloride als bijproducten. Het resulterende Ca(OH)2 wordt vervolgens gezuiverd en gedroogd.
Bij de calciumcarbonaatmethode wordt calciumcarbonaat eerst verwarmd om calciumoxide en kooldioxide te produceren. Bij het hydratatieproces wordt calciumoxide met water gemengd, waardoor Ca(OH)2 ontstaat.
Gebruik van calciumhydroxide
Ca(OH)2 heeft vele toepassingen in diverse industrieën, waaronder:
- Constructie: Gebruikt als een belangrijk onderdeel bij de productie van beton, mortel en stucwerk vanwege het vermogen om deze materialen te versterken en de duurzaamheid ervan te vergroten.
- Landbouw: Gebruikt als bodemverbetering om de zuurgraad van de bodem te verminderen en de bodemvruchtbaarheid te verbeteren.
- Waterbehandeling: Wordt gebruikt om water te verzachten door onzuiverheden zoals magnesium- en calciumionen te verwijderen.
- Chemische productie: gebruikt bij de productie van verschillende chemicaliën zoals calciumstearaat, calciumhypochloriet en calciumfosfaat.
- Voedingsindustrie: gebruikt als voedingsadditief om de zuurgraad in voedingsproducten zoals augurken, olijven en frisdranken te reguleren.
- Medische industrie: Gebruikt in diverse tandheelkundige procedures, zoals wortelkanaalbehandelingen en holtevullingen, vanwege de antimicrobiële en schimmelwerende eigenschappen.
- Pulp- en papierindustrie: Gebruikt bij de papierproductie om de glans en sterkte van papier te verbeteren.
- Leerindustrie: Gebruikt bij leerverwerking om haren en onzuiverheden te verwijderen.
Vragen:
Vraag: Is calciumhydroxide oplosbaar?
A: Ca(OH)2 is matig oplosbaar in water, met een oplosbaarheid van ongeveer 1,2 g/L bij kamertemperatuur.
Vraag: Wat is de formule voor calciumhydroxide?
A: De formule voor calciumhydroxide is Ca(OH)2.
Vraag: Waar kan ik calciumhydroxide bij mij in de buurt kopen?
A: Ca(OH)2 kan worden gekocht bij chemische winkels, bouwmarkten of online winkels. U kunt zoeken naar chemische winkels of bouwmarkten bij u in de buurt of online winkels zoals Amazon of eBay raadplegen.
Vraag: Is Ca(OH)2 een zuur of een base?
A: Ca(OH)2 is een base. Het is een sterke base die in water volledig dissocieert en calciumionen (Ca2+) en hydroxide-ionen (OH-) vormt.
Vraag: Wanneer de reactie H3PO4(aq)+Ca(OH)2(aq)→ plaatsvindt, wat is dan de formule van het gevormde zout?
A: De reactie tussen H3PO4(aq) en Ca(OH)2(aq) produceert calciumfosfaat (Ca3(PO4)2) en water (H2O) als respectievelijk zout en bijproduct.
Vraag: Is Ca(OH)2 oplosbaar in water?
A: Ja, Ca(OH)2 is matig oplosbaar in water. Het kan in water oplossen en een verzadigde oplossing vormen met een concentratie van ongeveer 1,2 g/l bij kamertemperatuur.
Vraag: Is Ca(OH)2 een sterke base?
A: Ja, Ca(OH)2 is een sterke base. Het is een zeer basische verbinding die in water volledig dissocieert en Ca2+- en OH–ionen vormt, waardoor het een sterke base wordt.
Vraag: Welke worden geproduceerd als HCl reageert met Ca(OH)2?
A: Wanneer HCl reageert met Ca(OH)2, zijn de gevormde producten calciumchloride (CaCl2) en water (H2O), omdat de H+ ionen van HCl reageren met de OH-ionen van Ca(OH)2 om water te vormen, terwijl de resterende Ca2+ en Cl-ionen vormen het zout, calciumchloride.
