Kaliumcarbonaat (K2CO3) is een wit, geurloos poeder dat veel wordt gebruikt bij de productie van zeep, glas en keramiek. Het kan ook worden gebruikt als voedingsadditief en buffermiddel in de farmaceutische industrie.
| Naam van IUPAC | Kaliumcarbonaat |
| Moleculaire formule | K2CO3 |
| CAS-nummer | 584-08-7 |
| Synoniemen | Koolzuur, dikaliumzout; Parel as; Potas; Zout van wijnsteen; Kaliummonocarbonaat; Kaliumwaterstofcarbonaat |
| InChi | InChI=1S/CH2O3,2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3,2K/q-2; M |
Eigenschappen van kaliumcarbonaat
Kaliumcarbonaatformule
De chemische formule voor kaliumcarbonaat is K2CO3. Deze formule vertegenwoordigt het exacte aantal atomen van elk element in de verbinding. De formule kan worden gebruikt om de molaire massa en andere eigenschappen van de verbinding te berekenen.
Kaliumcarbonaat molaire massa
K2CO3 heeft een molaire massa van 138,21 g/mol. Dit betekent dat één mol K2CO3 138,21 gram van de verbinding bevat. Molaire massa is belangrijk bij het bepalen hoeveel van een stof nodig is voor een bepaalde reactie of experiment. Het wordt ook gebruikt om de massa om te zetten in mol van een stof.
Kookpunt van kaliumcarbonaat
K2CO3 heeft een relatief hoog kookpunt van 1.620 °C (2.948 °F). Dit maakt het bruikbaar bij toepassingen bij hoge temperaturen, zoals de productie van glas en keramiek. Het kookpunt is de temperatuur waarbij een stof overgaat van een vloeistof naar een gas.
Kaliumcarbonaat smeltpunt
K2CO3 heeft een smeltpunt van 891°C (1.636°F). Dit relatief hoge smeltpunt is te wijten aan de ionische aard van de verbinding. Bij verhitting moeten de ionische bindingen tussen de kalium- en carbonaationen worden verbroken om de substantie te laten smelten.
Dichtheid van kaliumcarbonaat g/ml
De dichtheid van K2CO3 is 2,43 g/ml bij kamertemperatuur. Dit betekent dat een bepaald volume K2CO3 een bepaalde massa heeft. De dichtheid van een stof is een belangrijk kenmerk dat kan worden gebruikt om de stof te identificeren en de massa of het volume van een stof in een bepaalde ruimte te berekenen.
Kaliumcarbonaat Molecuulgewicht
Het molecuulgewicht van K2CO3 bedraagt 138,21 g/mol. Dit is de massa van één mol van de verbinding, wat belangrijk is bij veel chemische berekeningen.
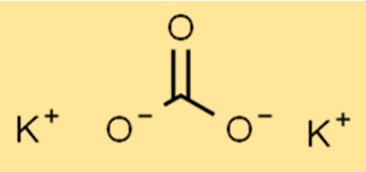
Structuur van kaliumcarbonaat
K2CO3 heeft een ionische structuur, met de formule K2CO3. Het kaliumion (K+) en het carbonaation (CO32-) worden bij elkaar gehouden door ionische bindingen. Het carbonaation is een polyatomisch ion dat bestaat uit één koolstofatoom en drie zuurstofatomen.
| Verschijning | Wit kristallijn poeder |
| Specifieke dichtheid | 2.43 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 138,21 g/mol |
| Dikte | 2,43 g/ml |
| Fusie punt | 891°C (1.636°F) |
| Kookpunt | 1620°C (2948°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 112 g/100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in water, glycerol en alcohol |
| Dampdruk | Verwaarloosbaar bij kamertemperatuur |
| Dampdichtheid | Niet toepasbaar |
| pKa | 10:33 uur |
| pH | 11,5 (waterige oplossing van 10 g/l) |
Kaliumcarbonaatveiligheid en gevaren
K2CO3 wordt over het algemeen als veilig beschouwd voor gebruik in industriële en huishoudelijke producten. Het kan echter irriterend zijn voor de huid en ogen, en inademing van het poeder kan irritatie van de luchtwegen veroorzaken. Langdurige blootstelling aan hoge concentraties K2CO3-stof kan longschade veroorzaken. Het is belangrijk om geschikte persoonlijke beschermingsmiddelen te dragen bij het hanteren van deze verbinding, inclusief handschoenen, een veiligheidsbril en een masker. K2CO3 is niet ontvlambaar of explosief, maar kan reageren met zuren en kooldioxide produceren, wat gevaarlijk kan zijn in besloten ruimtes. Indien ingeslikt of bij contact met de huid of ogen, onmiddellijk medische hulp inroepen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Draag handschoenen, een veiligheidsbril en een masker. Vermijd langdurig contact met huid en ogen. Adem het poeder niet in. |
| VN-identificatienummers | VN1863 |
| HS-code | 2836.40.00 |
| Gevarenklasse | Niet gevaarlijk |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Kaliumcarbonaat wordt niet als giftig beschouwd, maar kan bij hoge concentraties ademhalings- en huidirritatie veroorzaken. Langdurige blootstelling aan hoge stofconcentraties kan longschade veroorzaken. |
Synthesemethoden voor kaliumcarbonaat
Er zijn verschillende methoden om K2CO3 te synthetiseren
Een gebruikelijke methode is om kaliumhydroxide te laten reageren met kooldioxide.
Om het ontsnappen van kooldioxide te voorkomen, kan deze reactie in een gesloten container worden uitgevoerd.
Een andere methode omvat het laten reageren van kaliumchloride met natriumcarbonaat in een waterige oplossing. Het resulterende K2CO3 slaat neer uit de oplossing en kan door filtratie worden verzameld.
Een andere manier om K2CO3 te synthetiseren is door kaliumsulfaat te laten reageren met koolstof in aanwezigheid van houtskool. Historisch gezien gebruikten scheikundigen het Leblanc-proces om K2CO3 op industriële schaal te produceren. Milieuproblemen hebben dit proces tegenwoordig echter zeldzaam gemaakt, omdat er zwaveldioxide vrijkomt.
K2CO3 kan worden gesynthetiseerd uit kaliumbicarbonaat door het tot hoge temperaturen te verwarmen, waardoor het uiteenvalt in K2CO3 en koolstofdioxide. Een oven of oven kan deze reactie uitvoeren.
Gebruik van kaliumcarbonaat
K2CO3 heeft vanwege zijn unieke eigenschappen een breed scala aan toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen zijn:
- Glasproductie: gebruikt als vloeimiddel om het smeltpunt van silica en andere ingrediënten te verlagen.
- Voedingsindustrie: Gebruikt als voedingsadditief om de zuurgraad te reguleren en als afscheidingsmiddel bij het bakken.
- Zeep en wasmiddelen: Wordt ook gebruikt bij het maken van zepen en wasmiddelen als waterontharder.
- Farmaceutische industrie: gebruikt als buffermiddel bij het formuleren van geneesmiddelen.
- Meststof: Wordt ook gebruikt als meststof in de landbouw om planten van kalium te voorzien.
- Keramische productie: Gebruikt als vloeimiddel om de baktemperatuur te verlagen en de kwaliteit van het eindproduct te verbeteren.
- Vuurwerk: Wordt gebruikt bij de productie van vuurwerk om een paarse vlam te produceren.
- Batterijen: gebruikt bij de productie van batterijen als elektrolyt.
- Textielindustrie: Gebruikt als verfmiddel.
Vragen:
Vraag: Is kaliumcarbonaat oplosbaar?
A: Ja, kaliumcarbonaat is oplosbaar in water.
Vraag: Is K2CO3 oplosbaar in water?
A: Ja, K2CO3 is oplosbaar in water. Het is zelfs zeer oplosbaar en kan in water oplossen om een heldere, kleurloze oplossing te vormen.
Vraag: Hoeveel gram kaliumcarbonaat is nodig om 200 ml van een 2,5 M oplossing te bereiden?
A: Om een oplossing van 2,5 M K2CO3 in 200 ml water te bereiden, moet je 33,25 gram K2CO3 in water oplossen.
Berekening: Molariteit = mol / volume (in liters) 2,5 M = mol / 0,2 L mol = 0,5 molmassa = mol x molaire massa massa = 0,5 mol x 138,21 g/mol massa = 33,25 g
Vraag: Wat is de concentratie K-ionen in een 0,045 M K2CO3-oplossing, uitgaande van volledige dissociatie?
A: Wanneer K2CO3 volledig wordt gedissocieerd in water, vormt het twee K+-ionen en één CO3 2-ion. Daarom zou de concentratie van K+-ionen in een K2CO3-oplossing van 0,045 M tweemaal de molariteit van de K2CO3-oplossing zijn, namelijk 0,090 M.
