Kaliumpermanganaat (KMnO4) is een paarse kristallijne verbinding die voor verschillende doeleinden wordt gebruikt, zoals waterdesinfectie, behandeling van huidaandoeningen en als laboratoriumreagens. Het kan ook worden gebruikt als een krachtig oxidatiemiddel.
| IUPAC-naam | Kaliumpermanganaat |
| Moleculaire formule | KMnO4 |
| CAS-nummer | 7722-64-7 |
| Synoniemen | Kaliumpermanganaat, Condy-kristallen, kameleonmineraal, hypermangan, Kalium hypermanganicum |
| InChi | InChI=1S/K.Mn.4O/q+1;;;;-1 |
Eigenschappen van kaliumpermanganaat
Kaliumpermanganaatformule
De chemische formule voor kaliumpermanganaat is KMnO4. Het bestaat uit een kaliumion (K+), een mangaanion (MnO4^-) en vier zuurstofatomen (O). De formule geeft het type en het aantal atomen aan waaruit de verbinding bestaat. Het wordt gebruikt om chemische vergelijkingen te schrijven en om de massa en het aantal atomen in een bepaalde hoeveelheid stof te berekenen.
Kaliumpermanganaat Molaire massa
KMnO4 heeft een molaire massa van 158.034 g/mol. Dit betekent dat één mol KMnO4, wat overeenkomt met 6,022 x 10^23 moleculen, een massa heeft van 158,034 gram. De molaire massa van een verbinding wordt berekend door de atoommassa’s van alle elementen die in de verbinding aanwezig zijn, bij elkaar op te tellen. In het geval van KMnO4 wordt de molaire massa berekend door de atoommassa’s van kalium, mangaan en zuurstof op te tellen.
Kookpunt van kaliumpermanganaat
KMnO4 heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij atmosferische druk begint KMnO4 rond 240°C te ontbinden. Bij verhitting komt eerst zuurstof vrij en vormt kaliummanganaat, dat vervolgens uiteenvalt in kaliumoxide en mangaanoxide.
Kaliumpermanganaat Smeltpunt
KMnO4 heeft een hoog smeltpunt van 240°C. Dit betekent dat bij temperaturen onder 240°C KMnO4 in vaste toestand zal voorkomen. Bij verhitting ondergaat KMnO4 een reeks chemische veranderingen, waaronder het vrijkomen van zuurstof en de vorming van verschillende mangaanoxiden.
Dichtheid van kaliumpermanganaat g/ml
De dichtheid van KMnO4 is 2,703 g/ml bij kamertemperatuur. Dit betekent dat één milliliter KMnO4 2,703 gram weegt. De dichtheid van een stof is de verhouding tussen zijn massa en zijn volume. In het geval van KMnO4 maakt de hoge dichtheid het nuttig om het door filtratie van andere stoffen te scheiden.
Kaliumpermanganaat Molecuulgewicht
Het molecuulgewicht van KMnO4 is 158,034 g/mol. Deze waarde vertegenwoordigt de gemiddelde massa van een KMnO4-molecuul. Het wordt berekend door de atoommassa’s van kalium, mangaan en zuurstof waaruit de verbinding bestaat toe te voegen.
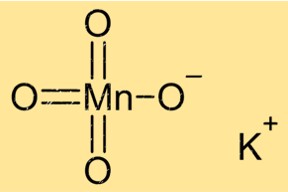
Structuur van kaliumpermanganaat
KMnO4 heeft een kristalstructuur met een monoklien kristalsysteem. De kristallen zijn paars van kleur en hebben een prismatische vorm. De verbinding heeft een octaëdrische coördinatiegeometrie, met zes zuurstofatomen die het centrale mangaanatoom omringen. Kaliumionen bevinden zich tussen lagen mangaan- en zuurstofatomen.
| Verschijning | Donkerpaarse kristallijne vaste stof |
| Soortelijk gewicht | 2.703 g/cm³ |
| Kleur | Donkerpaars |
| Geur | Geurloos |
| Molaire massa | 158.034 g/mol |
| Dikte | 2.703 g/cm³ |
| Fusie punt | 240°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 6,38 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in water, ethanol, aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 2.17 |
| pH | 7,2 – 8,9 (1% oplossing) |
Veiligheid en gevaren van kaliumpermanganaat
KMnO4 kan gevaarlijk zijn als er niet op de juiste manier mee wordt omgegaan. Het is een sterk oxidatiemiddel dat heftig kan reageren met reductiemiddelen, organische verbindingen en andere chemicaliën. Het kan irritatie aan de huid en ogen veroorzaken en kan schadelijk zijn bij inslikken of inademen. De verbinding kan ook vlekken op de huid en kleding veroorzaken. Bij het hanteren van KMnO4 moeten passende veiligheidsmaatregelen worden genomen, waaronder het dragen van beschermende kleding, een bril en handschoenen. Het moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen. Indien blootgesteld of ingeslikt, dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | O, Xn |
| Beveiligingsbeschrijving | S22, S26, S36/37/39, S45 |
| VN-identificatienummers | VN 1490 |
| HS-code | 28416100 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen. Kan huid- en oogirritatie veroorzaken. |
Methoden voor de synthese van kaliumpermanganaat
Er zijn verschillende methoden om KMnO4 te synthetiseren.
Eén methode omvat het laten reageren van mangaandioxide met kaliumhydroxide en een oxidatiemiddel, zoals chloor of waterstofperoxide.
Een andere methode is het laten reageren van kaliummanganaat met chloorgas .
Nog een andere methode omvat het laten reageren van kaliumhydroxide met mangaandioxide en het vervolgens oxideren van het resulterende mengsel met een oxidatiemiddel.
Het syntheseproces omvat gewoonlijk het verwarmen van de reactanten tot een specifieke temperatuur en het handhaven van de temperatuur gedurende een bepaalde tijd. Het proces bestaat uit het filteren van het resulterende mengsel en het verkrijgen van KMnO4 door kristallisatie.
Gebruik van kaliumpermanganaat
KMnO4 heeft verschillende toepassingen in verschillende industrieën vanwege de sterke oxiderende eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van KMnO4:
- Waterbehandeling: Wordt gebruikt om water te behandelen voor gemeentelijke en industriële doeleinden, omdat het onzuiverheden kan verwijderen en onaangename geuren kan elimineren.
- Medische toepassingen: plaatselijk gebruikt om huidaandoeningen (eczeem, dermatitis en schimmelinfecties) te behandelen.
- Laboratoriumgebruik: Gebruikt als oxidatiemiddel in verschillende laboratoriumexperimenten en als kleurstof in de biologie om cellen en weefsels te benadrukken.
- Landbouw: Gebruikt als fungicide en bactericide om gewassen te beschermen tegen schadelijke plagen en ziekten.
- Chemie: Gebruikt in de analytische chemie om de concentratie van bepaalde chemicaliën te bepalen en in de organische chemie als reagens bij chemische reacties.
- Brandbestrijding: Gebruikt als vlamvertrager en om bepaalde soorten branden te blussen.
- Industriële toepassingen: Gebruikt bij de productie van chemicaliën, textiel en batterijen.
Vragen:
Vraag: Welk gas komt vrij bij de afbraak van kaliumpermanganaat?
A: Wanneer KMnO4 wordt afgebroken, komt zuurstofgas (O2) vrij.
Vraag: Wat is kaliumpermanganaat?
A: Kaliumpermanganaat is een krachtig oxidatiemiddel met de chemische formule KMnO4.
Vraag: Wat is de chemische formule van kaliumpermanganaat?
A: De chemische formule voor kaliumpermanganaat is KMnO4.
Vraag: Waar kun je kaliumpermanganaatkristallen kopen?
A: KMnO4-kristallen kunnen worden gekocht bij chemische leveranciers, laboratoriumleveranciers en online retailers.
Vraag: Wat is KMnO4?
A: KMnO4 is de chemische formule voor kaliumpermanganaat.
Vraag: Wat is het oxidatiegetal van mangaan in KMnO4?
A: Het oxidatiegetal van mangaan in KMnO4 is +7.
Vraag: Wat is het oxidatiegetal van zuurstof in KMnO4?
A: Het oxidatiegetal van zuurstof in KMnO4 is -2.
Vraag: Hoeveel mol zit er in 25,0 gram KMnO4?
A: Om het aantal mol in 25,0 gram KMnO4 te berekenen, moeten we de gegeven massa delen door de molaire massa van KMnO4. De molaire massa van KMnO4 is 158,034 g/mol. Daarom zitten er ongeveer 0,158 mol KMnO4 in 25,0 gram.
