Fluormethaan (CH3F) is een kleurloos gas met een lichte etherische geur. Het wordt gebruikt bij de productie van elektronica, farmaceutische producten en als koelmiddel. Het is niet erg giftig, maar vormt een krachtig broeikasgas.
| IUPAC-naam | Fluormethaan |
| Moleculaire formule | CH3F |
| CAS-nummer | 593-53-3 |
| Synoniemen | Methylfluoride, Freon 41, Halogeenkoolstof 41, R 41, UN 2452 |
| InChi | InChI=1S/CH3F/c1-2/h1H3 |
Eigenschappen van fluormethaan
CH3F Kookpunt
Het kookpunt van CH3F is -78,4°C, wat relatief laag is. Dit maakt het een ideaal koelmiddel voor diverse toepassingen zoals koel- en airconditioningsystemen. CH3F wordt vanwege het lage kookpunt ook gebruikt als drijfgas in spuitbussen.
CH3F Molaire massa
CH3F is een chemische verbinding met de molecuulformule CH3F. Het is ook bekend als methylfluoride en heeft een molaire massa van 34,03 g/mol. CH3F is een kleurloos gas met een lichte etherische geur en wordt vanwege zijn unieke eigenschappen veel gebruikt in verschillende toepassingen.
CH3F Smeltpunt
CH3F heeft een smeltpunt van -141°C, wat ook relatief laag is. Het lage smeltpunt maakt het gemakkelijk te hanteren en te transporteren, waardoor het een populaire keuze is voor diverse industriële toepassingen. Het lage smeltpunt van CH3F maakt het ook geschikt voor gebruik als koelmiddel bij lage temperatuurtoepassingen.
Dichtheid CH3F
De dichtheid van CH3F is 0,89 g/ml, wat relatief laag is. Dit maakt het minder dicht dan lucht, die een dichtheid heeft van 1,29 g/ml. Als gevolg hiervan wordt CH3F vaak gebruikt als gas dat lichter is dan lucht in verschillende toepassingen, waaronder lekdetectie, gaschromatografie en als hefgas voor ballonnen en luchtschepen.
CH3F Moleculair gewicht
Het molecuulgewicht van CH3F is 34,03 g/mol, wat relatief laag is. Dit maakt het een lichtgewicht compound dat gemakkelijk te hanteren en te transporteren is. CH3F wordt vaak gebruikt bij de productie van elektronica en farmaceutische producten vanwege het lage molecuulgewicht en de unieke eigenschappen.
Structuur van CH3F
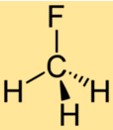
De structuur van CH3F bestaat uit een enkel koolstofatoom gebonden aan drie waterstofatomen en één fluoratoom. Het fluoratoom zit vast aan het koolstofatoom en vervangt een van de waterstofatomen in methaan. De structuur van CH3F maakt het een stabiele verbinding met unieke chemische eigenschappen.
Fluormethaan-formule
De formule voor fluormethaan is CH3F, wat de rangschikking van atomen in het molecuul vertegenwoordigt. De formule laat zien dat fluormethaan bestaat uit één koolstofatoom, drie waterstofatomen en één fluoratoom. De formule wordt gebruikt om de chemische samenstelling van fluormethaan te beschrijven en is belangrijk bij verschillende toepassingen.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,89 bij 20°C (lucht = 1) |
| Kleur | Kleurloos |
| Geur | Lichte etherische geur |
| Molaire massa | 34,03 g/mol |
| Dikte | 0,89 g/ml |
| Fusie punt | -141°C |
| Kookpunt | -78,4°C |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 0,5 g/l bij 20°C |
| Oplosbaarheid | Mengbaar met organische oplosmiddelen |
| Dampdruk | 4,4 bar bij 20°C |
| Dampdichtheid | 1,43 (lucht = 1) |
| pKa | 50,9 |
| pH | Niet toepasbaar |
Veiligheid en gevaren van fluormethaan
Fluormethaan wordt over het algemeen beschouwd als een veilige verbinding om te hanteren en te gebruiken, met een lage toxiciteit en niet-ontvlambaar. Zoals elke chemische stof brengt het echter potentiële gevaren en veiligheidsoverwegingen met zich mee. Blootstelling aan hoge concentraties fluormethaan kan duizeligheid, hoofdpijn en misselijkheid veroorzaken. Het is ook een krachtig broeikasgas dat bijdraagt aan de klimaatverandering. Fluormethaan moet worden verwerkt in een goed geventileerde ruimte en er moet beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gedragen. Het is belangrijk om de juiste opslag- en hanteringsprocedures te volgen om lekken en accidentele lozingen in het milieu te voorkomen.
| Gevarensymbolen | F+ |
| Beveiligingsbeschrijving | Licht ontvlambaar gas; Giftig bij inademing; Veroorzaakt huidirritatie; Veroorzaakt ernstige oogirritatie; Kan slaperigheid of duizeligheid veroorzaken; Kan orgaanschade veroorzaken |
| AN-identificaties | UN2452 |
| HS-code | 2903.49.90 |
| Gevarenklasse | 2.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Lage toxiciteit, maar kan gezondheidseffecten veroorzaken bij inademing bij hoge concentraties. |
Synthesemethoden voor fluormethaan
Verschillende methoden, waaronder directe methaanfluorering en halogeenuitwisselingsreacties, kunnen fluormethaan synthetiseren.
Een gebruikelijke methode is de reactie van methanol met waterstoffluoride in aanwezigheid van een katalysator, zoals aluminiumoxide of aluminiumfluoride.
Een andere methode omvat de reactie van chloormethaan of broommethaan met waterstoffluoridegas. Beide methoden produceren fluormethaan als bijproduct, dat vervolgens kan worden gescheiden en gezuiverd door destillatie of andere methoden.
Een andere methode voor het synthetiseren van fluormethaan omvat de reactie van fluoroform en waterstofchloride in aanwezigheid van een katalysator, zoals zink of koper. Deze reactie produceert een mengsel van chloorfluormethaan en fluormethaan, dat kan worden gescheiden en gezuiverd door destillatie.
Gebruik van fluormethaan
Fluormethaan heeft verschillende toepassingen in verschillende industrieën, waaronder:
- Koeling: Gebruikt als koelmiddel in industriële en commerciële koelsystemen vanwege het lage kookpunt en de onbrandbaarheid.
- Elektronica: Gebruikt als reinigingsmiddel voor elektronische componenten en als plasma-etsmiddel in de halfgeleiderindustrie.
- Medische toepassingen: Gebruikt als verdovingsmiddel in de diergeneeskunde vanwege de lage toxiciteit en snelle werking.
- Productie van pesticiden: Gebruikt als voorloper bij de productie van bepaalde pesticiden, waaronder herbiciden en insecticiden.
- Polymeerproductie: gebruikt als blaasmiddel bij de productie van polymeerschuimen, zoals polyurethaanschuim.
- Laboratoriumtoepassingen: Gebruikt als oplosmiddel en reagens in verschillende laboratoriumtoepassingen, waaronder chemische synthese en analyse.
- Brandbestrijding: Wordt ook gebruikt als brandblusser in bepaalde soorten brandblussers, vooral in computer- en telecommunicatieruimtes.
Vragen:
Vraag: Is CH3F polair of niet-polair?
A: CH3F is een polair molecuul vanwege de asymmetrische opstelling van fluor- en waterstofatomen rond het centrale koolstofatoom, wat resulteert in een netto dipoolmoment.
Vraag: Heeft CH3F een waterstofbrug?
A: Fluormethaan heeft geen waterstofbinding omdat het geen waterstofatoom bevat dat gebonden is aan een zeer elektronegatief element zoals stikstof, zuurstof of fluor.
Vraag: Welke verbinding heeft de sterkste intermoleculaire krachten: HF, CH3Cl, CH3F, HCl?
A: HF heeft de sterkste intermoleculaire krachten vanwege het vermogen om waterstofbruggen te vormen, die sterker zijn dan de dipool-dipoolkrachten van andere verbindingen.
Vraag: Welke heeft de zwakste dipool-dipoolkrachten: N2, CO, CH3F, HCl?
A: N2 heeft de laagste dipool-dipoolkrachten omdat het een niet-polair molecuul is en daarom geen netto dipoolmoment heeft. CO, CH3F en HCl zijn polaire moleculen en hebben dipool-dipoolkrachten, maar de sterkte van deze krachten neemt toe in de volgorde HCl < CH3F < CO vanwege de toenemende polariteit van de moleculen.
