Natriumperoxide (Na2O2) is een krachtig oxidatiemiddel. Het reageert heftig met water, waarbij zuurstof vrijkomt en bij contact brandbare materialen kan ontsteken. Het wordt gebruikt bij verschillende chemische reacties en als ontsmettingsmiddel.
| IUPAC-naam | natriumoxide |
| Moleculaire formule | Na2O2 |
| CAS-nummer | 1313-60-6 |
| Synoniemen | Natriumperoxide, natriumsuperoxide, dinatriumdioxide, natriumbinoxide, natriumdioxide, NaO2, UN 1507 |
| InChi | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
Eigenschappen van natriumperoxide
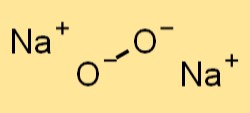
Natriumperoxide-formule
De chemische formule voor natriumperoxide is Na2O2. Het is een ionische verbinding bestaande uit twee natriumkationen (Na+) en een peroxide-anion (O22-). De formule voor natriumperoxide wordt gebruikt om de chemische samenstelling van de verbinding weer te geven en is belangrijk bij chemische reacties waarbij de stof betrokken is.
Molaire massa natriumperoxide
Natriumperoxide, chemische formule Na2O2, heeft een molaire massa van 77,98 g/mol. Het is een ionische verbinding bestaande uit twee natriumkationen (Na+) en een peroxide-anion (O22-). De molmassa van natriumperoxide is essentieel voor het berekenen van de hoeveelheid verbinding die nodig is voor verschillende chemische reacties.
Kookpunt van natriumperoxide
Natriumperoxide heeft een zeer hoog kookpunt van 657°C (1215°F), waardoor het extreem stabiel is bij hoge temperaturen. De verbinding ontleedt voordat het zijn kookpunt bereikt, waarbij zuurstofgas vrijkomt en natriumoxide achterblijft. Het hoge kookpunt van natriumperoxide maakt het bruikbaar bij reacties bij hoge temperaturen en industriële processen waarbij een hoge thermische stabiliteit vereist is.
Smeltpunt van natriumperoxide
Natriumperoxide heeft een smeltpunt van 675°C (1247°F), wat relatief hoog is vergeleken met andere veel voorkomende stoffen. Het smelt tot een geelachtig witte vloeistof en ontleedt boven het smeltpunt, waarbij zuurstofgas vrijkomt en natriumoxide ontstaat. Het hoge smeltpunt van natriumperoxide maakt het bruikbaar bij chemische reacties bij hoge temperaturen.
Dichtheid van natriumperoxide g/ml
De dichtheid van natriumperoxide is 2,805 g/ml. Het is een wit tot geelachtig poeder met een dichtheid groter dan die van water. De hoge dichtheid van natriumperoxide maakt het bruikbaar in verschillende industriële processen zoals bleken, desinfectie en de productie van andere chemicaliën.
Molecuulgewicht van natriumperoxide
Natriumperoxide heeft een molecuulgewicht van 77,98 g/mol. Het is een ionische verbinding met twee natriumkationen (Na+) en één peroxide-anion (O22-). Het molecuulgewicht van natriumperoxide is belangrijk bij chemische reacties waarbij de verbinding betrokken is, omdat het helpt bij het bepalen van de hoeveelheden reactanten en producten.
Structuur van natriumperoxide
Natriumperoxide heeft een kristalstructuur die lijkt op natriumchloride (NaCl). Het vormt een kubisch rooster met het gezicht in het midden, waarbij natriumionen de hoeken van de kubus bezetten en peroxide-anionen zich in het midden van elk vlak bevinden. De peroxide-anionen in natriumperoxide worden bij elkaar gehouden door covalente bindingen, terwijl de natriumionen bij elkaar worden gehouden door ionische bindingen.
| Verschijning: | Wit tot geelachtig poeder |
| Soortelijk gewicht: | 2.805 g/cm3 |
| Kleur: | Wit tot geelachtig |
| Geur: | Geurloos |
| Molaire massa: | 77,98 g/mol |
| Dikte: | 2.805 g/cm3 |
| Fusiepunt: | 675°C (1247°F) |
| Kookpunt: | 657°C (1215°F) |
| Vlampunt: | Niet toepasbaar |
| Oplosbaarheid in water: | Reageert hevig met water |
| Oplosbaarheid: | Oplosbaar in alcohol, ether |
| Dampdruk: | Niet toepasbaar |
| Dampdichtheid: | Niet toepasbaar |
| pKa: | Niet toepasbaar |
| pH: | Niet toepasbaar |
Veiligheid en gevaren van natriumperoxide
| Gevaarsymbolen: | Oxiderend, corrosief |
| Beveiligingsbeschrijving: | Stof/rook/gas/nevel/dampen niet inademen. Vermijd contact met huid/ogen. Behandelen en opslaan onder inert gas. Bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen. In geval van brand geschikte blusmiddelen gebruiken. |
| VN-identificatienummers: | UN1503 |
| HS-code: | 2829.11.00 |
| Gevarenklasse: | 5.1 |
| Verpakkingsgroep: | II |
| Toxiciteit: | Bijtend voor de ogen en de huid, schadelijk bij inslikken of inademen. |
Methoden voor de synthese van natriumperoxide
De synthese van natriumperoxide (Na2O2) is mogelijk via verschillende methoden, zoals directe combinatie, reactie met zuurstof en elektrolyse.
Eén methode voor het synthetiseren van Na2O2 is de directe combinatiemethode. Dit omvat het verwarmen van natriummetaal met overtollige zuurstof in een oven. De reactie is exotherm en het is essentieel om de temperatuur te regelen om oververhitting en mogelijke explosies te voorkomen.
Een andere methode omvat de reactie van natriumhydroxide met waterstofperoxide om Na2O2 en water te produceren. Deze methode is veiliger en gecontroleerder dan de directe combinatiemethode, maar vereist een hogere temperatuur en een langere reactietijd.
Een andere methode om Na2O2 te synthetiseren is door middel van elektrolyse. Dit omvat de elektrolyse van een natriumhydroxideoplossing met behulp van een geschikte anode en kathode. Tijdens elektrolyse produceert de kathode Na2O2, terwijl de anode zuurstofgas produceert.
Gebruik van natriumperoxide
Natriumperoxide vindt verschillende industriële en laboratoriumtoepassingen vanwege de oxiderende eigenschappen en het vermogen om zuurstof vrij te geven.
Hier zijn enkele veelvoorkomende toepassingen van natriumperoxide:
- Bleekmiddel: Gebruikt als bleekmiddel voor papierpulp, textiel en andere materialen.
- Geurverdrijvend middel: Gebruikt als geurverdrijvend middel in afvalverwerkings- en afvalwaterzuiveringsinstallaties.
- Oxidatiemiddel: gebruikt om verschillende organische en anorganische verbindingen te oxideren.
- Polymerisatie: Start de polymerisatie van bepaalde monomeren. Gebruikt bij de productie van polyurethaanschuim en andere polymeren.
- Farmaceutische toepassingen: Gebruikt als reagens bij de synthese van farmaceutische verbindingen.
- Laboratoriumreagens: Gebruikt als laboratoriumreagens voor verschillende analytische en synthetische doeleinden.
- Brandstofceltoepassingen: Gebruikt als oxidatiemiddel in brandstofcellen om elektrische energie op te wekken.
Vragen:
Vraag: Wat is de chemische reactie tussen waterstofperoxide en natriumbisulfiet?
A: De chemische reactie tussen waterstofperoxide en natriumbisulfiet produceert water en natriumsulfaat. De uitgebalanceerde vergelijking voor de reactie is: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
Vraag: Waar kan ik natriumperoxidepoeder kopen?
A: Natriumperoxidepoeder kan worden gekocht bij verschillende chemische leveranciers en distributeurs. Het is belangrijk om ervoor te zorgen dat de leverancier een goede reputatie heeft en de juiste veiligheidsprotocollen volgt voor het hanteren en verzenden van gevaarlijke chemicaliën.
Vraag: Kan natriumoxide worden omgezet in boorhydride en waterstofperoxide?
A: Natriumoxide kan niet rechtstreeks uit boorhydride en waterstofperoxide worden gemaakt. Natriumoxide kan worden gesynthetiseerd door de reactie van natriummetaal met zuurstof of door natriumhydroxide te verwarmen. Borohydride en waterstofperoxide worden niet vaak gebruikt bij de synthese van natriumoxide.
Vraag: Wat is de formule voor natriumperoxide?
A: De formule voor natriumperoxide is Na2O2.
Vraag: Wat is de oxidatietoestand van Na2O2?
A: De oxidatietoestand van natrium in Na2O2 is +1 en de oxidatietoestand van zuurstof is -1.
Vraag: Wat is het oxidatiegetal van zuurstof in de verbinding Na2O2?
A: Het oxidatiegetal van zuurstof in de verbinding Na2O2 is -1.
