Magnesiumnitraat is een witte kristallijne verbinding met de chemische formule Mg(NO3)2. Het wordt gebruikt bij de productie van meststoffen, explosieven en pyrotechnische producten vanwege de hoge reactiviteit en oxiderende eigenschappen.
| IUPAC-naam | Magnesiumdinitraat |
| Moleculaire formule | Mg(NO3)2 |
| CAS-nummer | 10377-60-3 |
| Synoniemen | Salpeterzuur, magnesiumzout; VN 1474; Magnesiumnitraat (II); Magnesiumzout van salpeterzuur (2+) |
| InChi | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Magnesiumnitraatformule
De chemische formule voor magnesiumnitraat is Mg(NO3)2, wat aangeeft dat de verbinding één magnesiumkation (Mg²⁺) en twee nitraatanionen (NO₃⁻) bevat. Deze formule wordt gebruikt om de stoichiometrie van de verbinding in chemische vergelijkingen weer te geven en wordt ook gebruikt om het molecuulgewicht en andere eigenschappen van magnesiumnitraat te bepalen.
Molaire massa van magnesiumnitraat
De molaire massa van magnesiumnitraat, weergegeven door de chemische formule Mg(NO3)2, bedraagt ongeveer 148,31 g/mol. Deze waarde kan worden berekend door de atoommassa’s van magnesium (24,31 g/mol), twee stikstofatomen (elk 28,02 g/mol) en zes zuurstofatomen (elk 16,00 g/mol) op te tellen die in de verbinding aanwezig zijn. Het kennen van de molaire massa is cruciaal bij het bepalen van de hoeveelheid magnesiumnitraat die nodig is voor chemische reacties of de bereiding van oplossingen.
Kookpunt van magnesiumnitraat
Mg(NO3)2 heeft een relatief hoog kookpunt van ongeveer 330°C (626°F) bij atmosferische druk. Deze waarde kan enigszins variëren, afhankelijk van de zuiverheid en concentratie van de verbinding. Het kookpunt van Mg(NO3)2 is belangrijk bij industriële processen waarbij kunstmest, explosieven en pyrotechniek worden geproduceerd, maar ook bij laboratoriumexperimenten.
Smeltpunt van magnesiumnitraat
Het smeltpunt van Mg(NO3)2, de temperatuur waarbij de vaste verbinding overgaat in een vloeibare toestand, bedraagt ongeveer 89°C (192°F) voor de watervrije vorm en 95°C (203°F) voor de watervrije vorm. hexahydrateerde vorm. De hexahydraatvorm van Mg(NO3)2 wordt vaker gebruikt vanwege de stabiliteit en het gebruiksgemak. Het smeltpunt is een essentiële fysieke eigenschap die wordt gebruikt om de zuiverheid van Mg(NO3)2 te bepalen, evenals in verschillende industriële processen.
Dichtheid van magnesiumnitraat g/ml
De dichtheid van Mg(NO3)2 varieert afhankelijk van de vorm van de verbinding. De watervrije vorm heeft een dichtheid van ongeveer 2,3 g/cm³, terwijl de hexahydraatvorm een dichtheid heeft van ongeveer 1,46 g/cm³. De dichtheid van Mg(NO3)2 is een cruciale factor bij het bepalen van het volume van de verbinding die nodig is bij chemische reacties, maar ook bij de opslag en het transport ervan.
Molecuulgewicht van magnesiumnitraat
Het molecuulgewicht van Mg(NO3)2, dat de som is van de atoomgewichten van alle elementen in de verbinding, bedraagt ongeveer 148,31 g/mol. Deze waarde is belangrijk bij verschillende chemische berekeningen, met name om de hoeveelheid Mg(NO3)2 te bepalen die nodig is bij reacties of bij de bereiding van oplossingen.
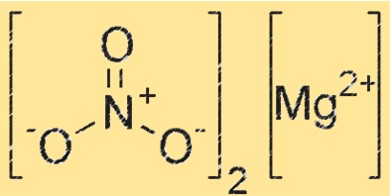
Structuur van magnesiumnitraat
Mg(NO3)2 heeft een kristalstructuur die behoort tot het orthorhombische kristalsysteem. De verbinding bestaat uit magnesiumkationen (Mg²⁺) en nitraatanionen (NO₃⁻), waarbij elk magnesiumkation omgeven is door zes nitraatanionen in een octaëdrische opstelling. De kristalstructuur van Mg(NO3)2 speelt een cruciale rol in de reactiviteit en eigenschappen ervan.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,3 (watervrij), 1,46 (hexahydraat) |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 148,31 g/mol |
| Dikte | 2,3 g/cm³ (watervrij), 1,46 g/cm³ (hexahydraat) |
| Fusie punt | 89°C (watervrij), 95°C (hexahydraat) |
| Kookpunt | 330°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 234 g/L (watervrij), 156 g/L (hexahydraat) bij 20°C |
| Oplosbaarheid | Oplosbaar in water, ethanol, methanol |
| Dampdruk | 0,000009 mmHg bij 20°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 1.8 |
| pH | 4,5-6,0 (5% oplossing) |
Veiligheid en gevaren van magnesiumnitraat
Mg(NO3)2 kan verschillende veiligheidsrisico’s met zich meebrengen als er niet op de juiste manier mee wordt omgegaan. Het kan bij contact of inademing irritatie en brandwonden aan de huid, ogen en luchtwegen veroorzaken. De verbinding is ook een sterk oxidatiemiddel en kan heftig reageren met organische materialen, inclusief ontvlambare en brandbare stoffen. Inademing van Mg(NO3)2-stof kan irritatie van de luchtwegen en zelfs longschade veroorzaken. Bewaar en hanteer Mg(NO3)2 in een koele, droge, goed geventileerde ruimte, uit de buurt van ontstekingsbronnen. Gebruik bij het hanteren van deze verbinding geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Vermijd contact met brandbare materialen. Draag persoonlijke beschermingsmiddelen. Verwijderd houden van ontstekingsbronnen. |
| AN-identificaties | VN 1474 |
| HS-code | 283429 |
| Gevarenklasse | 5.1 (Oxidatiemiddelen) |
| Verpakkingsgroep | II |
| Toxiciteit | LD50 (oraal, rat): 3.500 mg/kg; LD50 (cutaan, konijn): > 2000 mg/kg. Magnesiumnitraat wordt niet als carcinogeen, mutageen of teratogeen beschouwd. |
Methoden voor synthese van magnesiumnitraat
Magnesiumnitraat (Mg(NO3)2) kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van magnesiumoxide of magnesiumhydroxide met salpeterzuur.
Eén methode omvat het toevoegen van magnesiumoxide aan een oplossing van salpeterzuur in een kolf en het mengsel vervolgens voorzichtig verwarmen totdat het oplost. Om de Mg(NO3)2-kristallen te verkrijgen, filtreert u de oplossing om onzuiverheden te verwijderen en verdampt u het oplosmiddel.
Een andere synthesemethode omvat het laten reageren van magnesiummetaal met salpeterzuur . Voeg magnesiumstrips toe aan het zuur en laat de reactie doorgaan totdat al het metaal is opgelost. Damp vervolgens de verkregen oplossing in om de Mg(NO3)2-kristallen te verkrijgen.
Los magnesiumcarbonaat op in salpeterzuur om Mg(NO3)2 en kooldioxide te vormen. Filtreer de resulterende oplossing en damp deze in om Mg(NO3)2-kristallen te verkrijgen.
Een andere methode is om magnesiumhydroxide te laten reageren met salpeterzuur om Mg(NO3)2 en water te produceren. De verkregen oplossing wordt vervolgens gezuiverd door filtratie en verdamping, waarbij Mg(NO3)2-kristallen worden verkregen.
Gebruik van magnesiumnitraat
Magnesiumnitraat heeft vele toepassingen in verschillende industrieën en toepassingen. Enkele van de belangrijkste toepassingen van Mg(NO3)2 zijn:
- Landbouw: Gebruikt als meststof, vooral voor gewassen die een hoog magnesiumgehalte vereisen, zoals tomaten, paprika’s en citrusvruchten. Het helpt de plantengroei te verbeteren en verbetert de gewaskwaliteit en opbrengst.
- Pyrotechnische producten: Gebruikt als oxidatiemiddel in vuurwerk en andere pyrotechnische toepassingen, omdat het heldere, intense vlammen kan produceren en de verbrandingssnelheid kan helpen beheersen.
- Glasproductie: Gebruikt als vloeimiddel bij de glasproductie om het smeltpunt van glas te verlagen en de vloei-eigenschappen te verbeteren.
- Chemische synthese: Gebruikt als reagens bij verschillende chemische synthesereacties, zoals de productie van andere magnesiumverbindingen, katalysatoren en farmaceutische producten.
- Conservering: Gebruikt als voedselconserveermiddel om de groei van bacteriën en andere micro-organismen te remmen.
- Industriële toepassingen: Gebruikt bij de productie van magnesiumoxide en magnesiumhydroxide, die worden gebruikt als vlamvertragers, bij de behandeling van afvalwater en als neutralisatiemiddel in zure grond.
- Laboratoriumonderzoek: Gebruikt in verschillende laboratoriumexperimenten en onderzoek, zoals het voorbereiden van standaardoplossingen en het testen van analytische procedures.
Vragen:
Vraag: Is Mg(NO3)2 oplosbaar?
A: Ja, magnesiumnitraat is zeer oplosbaar in water.
Vraag: Wat is de formule voor magnesiumnitraat?
A: De formule voor magnesiumnitraat is Mg(NO3)2.
Vraag: Wat is de molaire massa van Mg(NO3)2?
A: De molaire massa van Mg(NO3)2 is 148,31 g/mol.
Vraag: Wat is het formulegewicht van Mg(NO3)2?
A: Het formulegewicht van Mg(NO3)2 is 148,31 g/mol.
Vraag: Wat is de systematische naam van Mg(NO3)2?
A: De systematische naam voor Mg(NO3)2 is magnesiumdinitraat.
Vraag: Wat is de concentratie nitraationen in een 0,125 M Mg(NO3)2-oplossing?
A: De concentratie nitraationen in een 0,125 M Mg(NO3)2-oplossing is 0,25 M, omdat er voor elk magnesiumion twee nitraationen zijn.
Vraag: Wat is de formulemassa van Mg(NO3)2?
A: De formulemassa van Mg(NO3)2 is 148,31 g/mol.
