Bariumchloridedihydraat is een witte kristallijne verbinding met de chemische formule BaCl2·2H2O. Het wordt in het laboratorium vaak gebruikt als reagens en in de industrie voor de behandeling van metalen oppervlakken.
| IUPAC-naam | Bariumchloridedihydraat |
| Moleculaire formule | BaCl2·2H2O |
| CAS-nummer | 10326-27-9 |
| Synoniemen | Bariumdichloridedihydraat; Barium(II)chloridedihydraat; Gehydrateerd bariumchloride (1:2:2); Bariumchloride 2-hydraat; Bariumchloridedihydraat; Bariumdichloride, dihydraat; Barium(2+)chloridedihydraat |
| InChi | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
Molaire massa BaCl2·2H2O
De molaire massa van bariumchloridedihydraat (BaCl2·2H2O) is 244,26 g/mol. Deze waarde kan worden berekend door de atoommassa’s van elk element in de verbinding op te tellen. Barium heeft een molmassa van 137,33 g/mol, chloor heeft een molmassa van 35,45 g/mol en waterstof en zuurstof hebben respectievelijk een molmassa van 1,01 g/mol en 16,00 g/mol. De twee watermoleculen voegen nog eens 36,02 g/mol toe. De molaire massa van BaCl2·2H2O is belangrijk bij stoichiometrische berekeningen waarbij de hoeveelheid reactant of product wordt uitgedrukt in mol.
Bariumchloridedihydraatformule
De chemische formule voor bariumchloridedihydraat is BaCl2·2H2O. Deze formule geeft aan dat elke formule-eenheid van de verbinding één bariumion, twee chloride-ionen en twee watermoleculen bevat. De formule is belangrijk voor stoichiometrische berekeningen en voor het begrijpen van de chemische en fysische eigenschappen van de verbinding.
Kookpunt van bariumchloridedihydraat
BaCl2·2H2O heeft een kookpunt van 1560°C. Bij deze temperatuur zal de verbinding een faseovergang ondergaan van een vloeistof naar een gas. Het hoge kookpunt is te wijten aan de ionische aard van de verbinding, die een grote hoeveelheid energie vereist om de sterke elektrostatische krachten af te breken die de ionen bij elkaar houden. BaCl2 · 2H2O wordt in de industrie gebruikt als warmtebehandelingsmiddel voor metalen oppervlakken vanwege de hoge smelt- en kookpunten.
Smeltpunt van bariumchloridedihydraat
Het smeltpunt van BaCl2 · 2H2O is 962 °C. Bij deze temperatuur verandert de verbinding van een vaste stof in een vloeistof. Het hoge smeltpunt van BaCl2·2H2O is te wijten aan de sterke ionische bindingen tussen barium- en chloorionen, evenals aan waterstofbruggen tussen watermoleculen. Het smeltpunt van BaCl2·2H2O is een belangrijke eigenschap voor het gebruik ervan in diverse toepassingen, zoals de productie van pigmenten en kleurstoffen, en de behandeling van metalen oppervlakken.
Dichtheid van bariumchloridedihydraat g/ml
De dichtheid van bariumchloridedihydraat is 3,097 g/cm³. Dit betekent dat 1 cm³ bariumchloridedihydraat 3,097 gram weegt. De dichtheid van een stof is een belangrijke eigenschap die inzicht kan geven in de fysische en chemische eigenschappen ervan. In het geval van bariumchloridedihydraat is de hoge dichtheid te wijten aan de relatief grote atoommassa van barium en de nauwe pakking van ionen in de kristalroosterstructuur.
BaCl2 · 2H2O molecuulgewicht
Het molecuulgewicht van BaCl2·2H2O is 244,26 g/mol. Deze waarde kan worden berekend door de atoomgewichten van elk element in de verbinding op te tellen. Het molecuulgewicht is een belangrijke eigenschap van BaCl2 · 2H2O omdat het in verschillende toepassingen wordt gebruikt, zoals de productie van pigmenten en kleurstoffen, en als reagens in laboratoriumexperimenten.
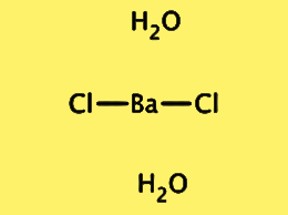
Structuur BaCl2·2H2O
De kristalstructuur van BaCl2·2H2O is orthorhombisch, met ruimtegroep Pnma. De eenheidscel bevat één eenheid met de formule BaCl2·2H2O, bestaande uit één bariumion, twee chloride-ionen en twee watermoleculen. Het bariumion is omgeven door acht chloride-ionen en de watermoleculen zijn waterstofgebonden aan de chloride-ionen. De kristalstructuur van BaCl2 · 2H2O is belangrijk voor het begrijpen van de fysische en chemische eigenschappen ervan, evenals voor het gebruik ervan in verschillende toepassingen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 3,097 g/cm³ |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 244,26 g/mol |
| Dikte | 3,097 g/cm³ |
| Fusie punt | 962°C |
| Kookpunt | 1560°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 31,2 g/100 ml (bij 20°C) |
| Oplosbaarheid | Oplosbaar in alcohol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutraal (7) |
Opmerking: De tabel is mogelijk niet correct uitgelijnd, afhankelijk van de weergave-instellingen van het platform of apparaat dat u gebruikt.
Veiligheid en gevaren van bariumchloridedihydraat
BaCl2 2H2O brengt verschillende veiligheids- en gezondheidsrisico’s met zich mee, die schadelijk kunnen zijn als er niet op de juiste manier mee wordt omgegaan. Het is een bijtende stof die bij contact ernstige brandwonden aan de huid en ogen kan veroorzaken. Inademing van stof of dampen kan ademhalingsproblemen en longschade veroorzaken. Het is ook giftig bij inslikken en kan gastro-intestinale problemen veroorzaken. BaCl2 · 2H2O moet met voorzichtigheid worden gehanteerd en geschikte beschermende uitrusting zoals handschoenen, een veiligheidsbril en een gasmasker moeten worden gedragen bij het werken met de verbinding. Het moet uit de buurt van onverenigbare stoffen en in een veilige ruimte worden bewaard om accidentele blootstelling te voorkomen. In geval van nood dient u onmiddellijk medische hulp in te roepen.
| Gevarensymbolen | Corrosief (C) | |
| Beveiligingsbeschrijving | ||
| AN-identificaties | VN1564 | |
| HS-code | 28273990 | |
| Gevarenklasse | 8 | |
| Verpakkingsgroep | III | |
| Toxiciteit | Giftig bij inslikken; kan maag-darmproblemen veroorzaken. Bijtend voor huid en ogen. Het inademen van stof of damp kan ademhalingsproblemen en longschade veroorzaken. | |
Methoden voor de synthese van bariumchloridedihydraat
Je kunt BaCl2 · 2H2O op verschillende manieren synthetiseren.
Een gebruikelijke methode is om bariumcarbonaat of bariumhydroxide te laten reageren met zoutzuur. U moet de resulterende oplossing verdampen om de vaste verbinding te verkrijgen.
Een andere methode is om bariumsulfide te laten reageren met zoutzuur. Bij deze reactie ontstaat waterstofsulfidegas, dat u op de juiste manier moet afvoeren. De verkregen oplossing wordt vervolgens gezuiverd door filtratie en kristallisatie om het eindproduct te verkrijgen.
Je kunt BaCl2 · 2H2O ook synthetiseren door een precipitatiereactie met behulp van natriumchloride en bariumnitraat. U moet de twee verbindingen in een oplossing mengen en vervolgens het resulterende neerslag filteren en drogen om de vaste verbinding te verkrijgen.
Bovendien kan BaCl2 · 2H2O worden gesynthetiseerd door de reactie van bariumoxide met zoutzuur. Bij deze reactie ontstaat water als bijproduct, dat je door verdamping moet verwijderen. De verkregen oplossing wordt vervolgens gekristalliseerd om het eindproduct te verkrijgen.
Wanneer u met BaCl2 · 2H2O werkt, moet u passende veiligheidsmaatregelen nemen, aangezien het een bijtende en giftige verbinding is. U moet beschermende uitrusting dragen, zoals handschoenen, een veiligheidsbril en een gasmasker, en het mengsel in een goed geventileerde ruimte hanteren.
Gebruik van bariumchloridedihydraat
BaCl2 2H2O heeft verschillende toepassingen in verschillende industrieën.
- De chemische industrie gebruikt BaCl2 · 2H2O als reagens bij verschillende chemische reacties, zoals de productie van bariumzouten, pigmenten en keramiek.
- Het functioneert als een stroom bij de metaalraffinage en als een katalysator bij de organische synthese.
- De medische industrie gebruikt BaCl2 · 2H2O als contrastmiddel bij radiografie en om bariumvergiftiging te behandelen. Het wordt ook gebruikt bij de vervaardiging van tandheelkundige cementen.
- De textielindustrie gebruikt BaCl2 · 2H2O als beitsmiddel, een stof die kleurstoffen aan vezels bindt, en als vlamvertrager voor textiel.
- In de aardolie-industrie wordt BaCl2 · 2H2O gebruikt als additief aan boorspoeling om de dichtheid van de spoeling te vergroten en uitbarstingen tijdens boorwerkzaamheden te voorkomen.
- De voedingsindustrie gebruikt BaCl2 · 2H2O als conserveermiddel en smaakversterker voor bepaalde voedingsmiddelen.
Passende veiligheidsmaatregelen, zoals het dragen van beschermende uitrusting en het hanteren van de verbinding in een goed geventileerde ruimte, moeten worden genomen om de risico’s die gepaard gaan met het werken met het corrosieve en giftige BaCl2·2H2O tot een minimum te beperken.
Vragen:
Wat is de formule voor bariumchloridedihydraat?
De formule voor bariumchloridedihydraat is BaCl2·2H2O.
Is bariumchloridedihydraat oplosbaar in water?
Ja, bariumchloridedihydraat is zeer oplosbaar in water. Het lost gemakkelijk op in water, met een oplosbaarheid van ongeveer 31,2 g/100 ml bij kamertemperatuur. Deze hoge oplosbaarheid maakt het een bruikbare verbinding in verschillende industrieën, zoals bij de productie van bariumzouten en als boorspoelingsadditief in de aardolie-industrie. De hoge oplosbaarheid betekent echter ook dat het een risico kan vormen voor de menselijke gezondheid en het milieu als het niet op de juiste manier wordt behandeld, omdat het waterbronnen kan verontreinigen en toxiciteit voor in het water levende organismen kan veroorzaken. Daarom moeten passende voorzorgsmaatregelen worden genomen bij het werken met BaCl2 · 2H2O om besmetting te voorkomen en een veilige omgang te garanderen.
