Nikkelsulfide (NiS) is een verbinding van nikkel en zwavel. Het wordt gebruikt in verschillende industrieën, waaronder keramiek en glas, vanwege zijn unieke eigenschappen en toepassingen.
| IUPAC-naam | Nikkelsulfide |
| Moleculaire formule | NiS |
| CAS-nummer | 16812-54-7 |
| Synoniemen | Nikkel(II)sulfide, nikkelmonosulfide, nikkelsulfide |
| InChi | InChI=1S/Ni.S/q+2;-2 |
Eigenschappen van nikkelsulfide
Nikkelsulfide-formule
De chemische formule voor nikkelmonosulfide is NiS. Het bestaat uit één nikkelatoom (Ni) en één zwavelatoom (S), wat wijst op een één-op-één-verhouding tussen de twee elementen.
Nikkelsulfide Molaire massa
De molaire massa van nikkelmonosulfide (NiS) is ongeveer 90,76 gram per mol (g/mol). Deze waarde wordt berekend door de atoommassa’s van een nikkelatoom en een zwavelatoom bij elkaar op te tellen.
Kookpunt van nikkelsulfide
Nikkelsulfide heeft geen goed gedefinieerd kookpunt, omdat het vanwege zijn chemische eigenschappen de neiging heeft te ontleden voordat het zijn kookpunt bereikt. Deze ontleding kan echter optreden bij hoge temperaturen.
Nikkelsulfide Smeltpunt
Het smeltpunt van nikkelmonosulfide is ongeveer 797 graden Celsius (1.467 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop vast nikkelmonosulfide overgaat in de vloeibare toestand.
Dichtheid van nikkelsulfide g/ml
De dichtheid van nikkelmonosulfide is ongeveer 5,9 gram per kubieke centimeter (g/cm³). Deze dichtheidswaarde geeft de massa nikkelmonosulfide per volume-eenheid aan en is relatief hoog vanwege de compacte opstelling van de atomen.
Molecuulgewicht van nikkelsulfide
Het molecuulgewicht van nikkelmonosulfide (NiS) is ongeveer 90,76 g/mol. Deze waarde wordt bepaald door de atoomgewichten van nikkel en zwavel die in de verbinding aanwezig zijn, op te tellen.
Structuur van nikkelsulfide
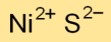
Nikkelmonosulfide kan verschillende kristalstructuren aannemen, waaronder hexagonale en kubieke arrangementen. Deze structuren beïnvloeden de fysische en chemische eigenschappen ervan, waardoor het bruikbaar is in verschillende toepassingen, zoals halfgeleiders en katalysatoren.
Oplosbaarheid van nikkelsulfide
Nikkelmonosulfide heeft een beperkte oplosbaarheid in water en vele andere oplosmiddelen. De oplosbaarheid hangt af van factoren zoals temperatuur, pH en de aanwezigheid van andere ionen. Over het algemeen wordt het als onoplosbaar in waterige oplossingen beschouwd. Het kan echter reageren met zuren om oplosbare nikkelzouten te vormen.
| Verschijning | Effen zwart |
| Soortelijk gewicht | 5,9 g/cm³ |
| Kleur | Zwart |
| Geur | Geurloos |
| Molaire massa | 90,76 g/mol |
| Dikte | 5,9 g/cm³ |
| Fusie punt | 797°C (1467°F) |
| Kookpunt | Ontleedt bij hoge temperaturen |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Beperkte oplosbaarheid |
| Oplosbaarheid | Onoplosbaar in water, reageert met zuren en vormt oplosbare nikkelzouten |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Nikkelsulfideveiligheid en gevaren
Nikkelmonosulfide brengt potentiële veiligheidsrisico’s met zich mee. Inademing of inslikken van het stof kan irritatie van de luchtwegen en spijsverteringsproblemen veroorzaken. Huidcontact kan irritatie of dermatitis veroorzaken, vooral bij gevoelige personen. Langdurige blootstelling aan hoge concentraties kan tot ernstigere ademhalingsproblemen leiden. Bij verbranding of ontbinding komen giftige dampen vrij, waarvoor adequate ventilatie en beschermende uitrusting nodig zijn. Veilig hanteren omvat het gebruik van handschoenen, een veiligheidsbril en een laboratoriumjas. Vermijd contact met ogen, huid en kleding. Indien blootgesteld, spoel de getroffen gebieden met water en zoek medische hulp als de symptomen aanhouden. Volg altijd de veiligheidsinstructies en werk in goed geventileerde ruimtes.
| Gevarensymbolen | Irriterend, gevaar voor de gezondheid |
| Beveiligingsbeschrijving | Breekbaar. Gebruik geschikte beschermende uitrusting. Vermijd contact met de huid, ogen en inademing van stof. Werk in goed geventileerde ruimtes. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | Niet toepasbaar |
| Gevarenklasse | Milieurisico (N) |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Kan irritatie veroorzaken; langdurige blootstelling aan hoge concentraties kan tot ernstigere ademhalingsproblemen leiden. |
Nikkelsulfidesynthesemethoden
Nikkelmonosulfide kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak omvat de reactie tussen een oplosbaar Ni-zout, zoals NiCl2 of Ni(NO3)2 , en een oplosbare sulfidebron, zoals natriumsulfide of waterstofsulfidegas. Deze precipitatiemethode levert vast nikkelmonosulfide als product op.
Een andere methode is de thermische ontleding van nikkelverbindingen in aanwezigheid van zwavelbronnen. Het verwarmen van nikkelzouten zoals nikkelcarbonaat of nikkelhydroxide met zwavel bij hoge temperaturen kan bijvoorbeeld nikkelmonosulfide produceren.
Chemische dampafzetting (CVD) wordt gebruikt voor de afzetting van dunne films van nikkelmonosulfide. Bij deze methode worden gasvormige nikkel- en zwavelvoorlopers in een gecontroleerde omgeving gebracht, waar ze reageren en een dunne laag nikkelmonosulfide op een substraat vormen.
Hydrothermische synthese omvat het laten reageren van waterige oplossingen van nikkelzouten en zwavelverbindingen bij hoge temperatuur en druk. Deze methode maakt de gecontroleerde vorming van nikkelmonosulfide-nanodeeltjes mogelijk.
Over het geheel genomen bieden deze methoden diverse manieren om nikkelmonosulfide te synthetiseren en voldoen ze aan verschillende toepassingen en vereisten in industrieën zoals elektronica, katalyse en materiaalkunde.
Gebruik van nikkelsulfide
Nikkelmonosulfide vindt veelzijdige toepassingen in verschillende industrieën vanwege zijn unieke eigenschappen. Enkele belangrijke toepassingen zijn onder meer:
- Katalysatoren: Het dient als katalysator bij verschillende chemische reacties, waaronder hydrogenerings- en ontzwavelingsprocessen in de aardolie-industrie.
- Halfgeleiders: Fabrikanten gebruiken nikkelmonosulfide om halfgeleiders te maken, vooral in dunnefilmzonnecellen, waar het dient als een essentieel onderdeel binnen de absorberlaag.
- Glas en keramiek: Nikkelmonosulfide verbetert zowel de kleur als de dekking van glas en keramiek en speelt een cruciale rol bij de productie van decoratieve en functionele objecten.
- Thermo-elektrische materialen: Onderzoekers bestuderen nikkelmonosulfide vanwege zijn thermo-elektrische eigenschappen, met als doel het vermogen ervan te benutten om warmteverschillen om te zetten in elektrische energie in thermo-elektrische apparaten.
- Elektroden: Oplaadbare batterijen profiteren van nikkelmonosulfide omdat het als elektrodemateriaal functioneert vanwege zijn uitzonderlijke elektrische geleidbaarheid en stabiliteit.
- Gassensoren: Nikkelmonosulfidematerialen spelen een sleutelrol in gassensoren en maken de detectie van gassen zoals waterstof, ammoniak en zwaveldioxide mogelijk.
- Geneeskunde: In verschillende medische toepassingen wordt nikkelmonosulfide op nanoschaal gebruikt voor medicijnafgiftesystemen en de behandeling van kanker.
- Gezwaveld glas: Het draagt bij aan de vorming van gezwaveld glas met unieke optische eigenschappen, geschikt voor infraroodoptiek.
- Brandstofcellen: Nikkelmonosulfide-nanodeeltjes worden onderzocht voor mogelijke toepassingen in brandstofcellen vanwege hun elektrokatalytische eigenschappen.
- Corrosiebestendigheid: Wanneer het aan metalen wordt toegevoegd, verbetert het hun corrosieweerstandseigenschappen.
Het aanpassingsvermogen van nikkelmonosulfide in verschillende sectoren toont aan dat het waardevol is bij het bijdragen aan de vooruitgang op het gebied van materialen, elektronica, energie en nog veel meer.
Vragen:
Vraag: Wat is de formule voor nikkel(ii)sulfide?
A: De formule voor nikkel(II)monosulfide is NiS.
Vraag: Is nikkelsulfide oplosbaar?
A: Nikkelmonosulfide is over het algemeen onoplosbaar in water.
Vraag: Is nikkel-ii-sulfide oplosbaar in water?
A: Nee, nikkel(II)monosulfide is onoplosbaar in water.
Vraag: Is nikkel(ii)sulfide oplosbaar of onoplosbaar?
A: Nikkel(II)monosulfide is onoplosbaar in water.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van nikkel (ii) chloride en natriumsulfide worden gecombineerd?
A: Ja, er vindt een reactie plaats, waarbij nikkel(II)monosulfide ontstaat als een vast neerslag.
Vraag: Wat is de molaire oplosbaarheid van nikkel(ii)sulfide in 0,053 m kcn?
A: De molaire oplosbaarheid van nikkel(II)monosulfide in 0,053 M KCN wordt berekend op basis van specifieke evenwichtsconstanten.
Vraag: Wat is het resultaat van een reactie tussen nikkel(iii)nitraat en rubidiumsulfide?
A: Een reactie tussen nikkel(III)nitraat en rubidiumsulfide resulteert in de vorming van producten die worden bepaald door hun respectievelijke chemische eigenschappen.
Vraag: Hoe schrijf je een formule als nikkel(ii)sulfide wordt gevonden?
A: De formule voor nikkel(II)monosulfide is NiS.
