Zinkfluoride (ZnF2) is een chemische verbinding. Het bestaat uit zink en fluor. Vanwege zijn unieke eigenschappen wordt het gebruikt in verschillende industrieën, zoals de tandheelkunde en de elektronica.
| IUPAC-naam | Zinkfluoride |
| Moleculaire formule | ZnF2 |
| CAS-nummer | 7783-49-5 |
| Synoniemen | Zinkdifluoride, zink(II)fluoride |
| InChi | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschappen van zinkfluoride
Zinkfluoride-formule
De chemische formule voor zinkdifluoride is ZnF2. Deze formule betekent dat elk zinkdifluoridemolecuul bestaat uit één zinkatoom (Zn) en twee fluoratomen (F).
Zinkfluoride molaire massa
De molaire massa van zinkdifluoride (ZnF2) is ongeveer 103,38 g/mol. Deze waarde wordt berekend door de atoommassa’s van één zinkatoom en twee fluoratomen bij elkaar op te tellen.
Kookpunt van zinkfluoride
Zinkdifluoride heeft een kookpunt van ongeveer 872°C (1602°F). Dit is de temperatuur waarbij de verbinding onder standaard atmosferische druk van vloeistof naar gas verandert.
Zinkfluoride Smeltpunt
Het smeltpunt van zinkdifluoride is ongeveer 872°C (1602°F). Bij deze temperatuur verandert de vaste vorm van zinkdifluoride in een vloeistof.
Dichtheid van zinkfluoride g/ml
De dichtheid van zinkdifluoride is ongeveer 4,95 g/ml. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid en geeft de zwaarte ervan aan.
Zinkfluoride Molecuulgewicht
Het molecuulgewicht van zinkdifluoride (ZnF2) is ongeveer 103,38 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen in een molecuul van de verbinding.
Structuur van zinkfluoride
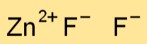
Zinkdifluoride (ZnF2) heeft een kristalstructuur waarin elk zinkatoom is omgeven door vier fluoride-ionen die in een tetraëdrische opstelling zijn gerangschikt. Deze opstelling draagt bij aan de stabiliteit van de verbinding.
Oplosbaarheid van zinkfluoride
Zinkdifluoride vertoont een beperkte oplosbaarheid in water. Het is slecht oplosbaar, wat betekent dat slechts een kleine hoeveelheid van de verbinding in water kan oplossen om een oplossing te vormen. Deze eigenschap is van belang voor diverse industriële toepassingen en chemische processen.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 4,95 g/cm³ |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 103,38 g/mol |
| Dikte | 4,95 g/ml |
| Fusie punt | 872°C (1602°F) |
| Kookpunt | 872°C (1602°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Beperkte oplosbaarheid |
| Oplosbaarheid | Slecht oplosbaar, slechts een kleine hoeveelheid kan in water oplossen |
| Dampdruk | Niet goed gedefinieerd |
| Dampdichtheid | Niet goed gedefinieerd |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Veiligheid en gevaren van zinkfluoride
Zinkdifluoride (ZnF2) brengt bepaalde veiligheidsoverwegingen met zich mee. Het is belangrijk om voorzichtig met dit mengsel om te gaan. Vermijd inademing of inslikken, omdat dit irritatie van de luchtwegen en het maagdarmkanaal kan veroorzaken. Draag bij het werken met ZnF2 geschikte persoonlijke beschermingsmiddelen zoals handschoenen en een veiligheidsbril om contact met huid en ogen te vermijden. In geval van accidenteel contact, spoel de getroffen gebieden met veel water. Bewaar zinkdifluoride uit de buurt van onverenigbare materialen en warmtebronnen. Hoewel het niet erg giftig is, is het verstandig om de juiste hanteringsprocedures te volgen en voor goede ventilatie te zorgen om de potentiële risico’s die aan het gebruik ervan zijn verbonden tot een minimum te beperken.
| Gevarensymbolen | Bijtend, irriterend, acuut giftig |
| Beveiligingsbeschrijving | Breekbaar. Vermijd inademing en inslikken. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 28261900 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor de synthese van zinkfluoride
Zinkdifluoride kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak omvat de reactie tussen zinkoxide (ZnO) en fluorwaterstofzuur (HF) . Bij deze methode wordt ZnO gemengd met HF, waardoor zinkdifluoride en water ontstaan. Een andere methode omvat de reactie tussen zinkcarbonaat (ZnCO3) en fluorwaterstofzuur. Zinkcarbonaat reageert met HF en produceert zinkdifluoride, kooldioxide en water.
Bovendien kan zinkdifluoride ook worden bereid door zinkmetaal te laten reageren met fluorgas (F2) bij hoge temperaturen. Deze reactie produceert direct zinkdifluoride waarbij warmte vrijkomt.
Bovendien kunnen precipitatiemethoden worden gebruikt, waarbij oplosbare zinkzouten reageren met oplosbare fluoridezouten om onoplosbaar zinkdifluoride te vormen, dat vervolgens kan worden gescheiden en verzameld.
Het is belangrijk om voorzichtig te zijn tijdens deze syntheseprocessen vanwege de reactiviteit van de betrokken chemicaliën. Er moeten passende veiligheidsmaatregelen en apparatuur worden gebruikt om de succesvolle en veilige synthese van zinkdifluoride te garanderen.
Gebruik van zinkfluoride
Zinkdifluoride (ZnF2) vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen in verschillende industrieën. Dit zijn de belangrijkste toepassingen:
- Tandverzorging: Versterk het tandglazuur en verbeter de mondhygiëne door ZnF2 in tandpastaformuleringen op te nemen.
- Optica en coatings: Verbeter de antireflectie-eigenschappen van lenzen en verbeter de lichttransmissie door ZnF2 te gebruiken in optische coatings.
- Elektronica: Integreer ZnF2 in dunnefilmtransistor (TFT)-schermen om transparante geleidende films te creëren.
- Fluoride-ionenbron: Gebruik ZnF2 als fluoride-ionenbron in elektrolytische cellen om reactieve metalen zoals aluminium te helpen produceren.
- Chemische synthese: Gebruik ZnF2 als katalysator en fluoreringsmiddel in verschillende chemische reacties om de synthese van farmaceutische en landbouwchemicaliën te vergemakkelijken.
- Galvaniseren: Breng ZnF2 aan bij metaalafwerkingsprocessen op metalen oppervlakken die klaar zijn om te worden gegalvaniseerd, waardoor de hechting en duurzaamheid worden verbeterd.
- Infraroodvensters: Fabriceer infraroodsensorvensters en warmtebeeldsystemen met behulp van ZnF2 vanwege de transparantie in het infraroodgebied.
- Lasertoepassingen: Gebruik ZnF2 als laserversterkingsmedium om bij te dragen aan de ontwikkeling van afstembare lasers voor wetenschappelijke en industriële doeleinden.
- Kristalgroei: Integreer ZnF2 in kristalgroeiprocessen voor halfgeleiders en andere elektronische componenten.
- Chemisch onderzoek: Gebruik ZnF2 als reactant en reactant in verschillende chemische reacties op laboratoriumschaal, waardoor de verkenning van nieuwe verbindingen wordt vergemakkelijkt.
Deze uiteenlopende toepassingen benadrukken het belang van zinkdifluoride in moderne technologie, productie en wetenschappelijk onderzoek op meerdere gebieden.
Vragen:
Vraag: Wat is de chemische formule van zinkfluoride?
A: De chemische formule voor zinkdifluoride is ZnF2.
Vraag: Wat is de formule voor zink(II)fluoride?
A: De formule voor zink(II)difluoride is ZnF2.
Vraag: Wat is de formule van de ionische verbinding gevormd uit zink- en fluoride-ionen?
A: De formule van de ionische verbinding gevormd uit Zn+2 en fluoride-ionen is ZnF2.
Vraag: Wat kan er gebeuren als gevolg van zink-, jodium- of fluoridetekorten?
A: Een tekort aan zink, jodium of fluoride kan leiden tot een verscheidenheid aan gezondheidsproblemen, die de stofwisseling, de schildklierfunctie en de tandgezondheid beïnvloeden.
Vraag: Welke van de volgende heeft geen ADH? A. ijzer B. zink c. jodium d. fluoride
A: Voor fluoride geldt geen aanbevolen dagelijkse hoeveelheid (ADH).
Vraag: Hoe kan zinkfluoride een mens beïnvloeden?
A: Zinkdifluoride kan mensen beïnvloeden door inslikken, inademen of mogelijk contact met de huid, wat mogelijk irritatie of toxiciteit veroorzaakt.
Vraag: Is ZnF2 ionisch of moleculair?
A: ZnF2 is een ionische verbinding.
Vraag: Waarom is het ZnF2 en niet ZnF?
A: ZnF2 geeft aan dat elk Zn-atoom gebonden is aan twee F-ionen, waardoor de juiste stoichiometrie ontstaat.
Vraag: Zullen ZnF2 en NaOH een neerslag vormen?
A: Ja, ZnF2 en NaOH kunnen een wit neerslag van zinkhydroxide (Zn(OH)2) vormen.
Vraag: Is ZnF2 oplosbaar?
A: ZnF2 is slecht oplosbaar in water.
Vraag: Wat is de naam van de verbinding met de formule ZnF2?
A: De verbinding met de formule ZnF2 wordt zinkdifluoride genoemd.
Vraag: De Ksp van ZnF2 is 3,0 × 10⁻² bij 25°C. Wat is ΔG°?
A: De waarde van ΔG° kan worden berekend op basis van de gegeven Ksp-waarde en temperatuur met behulp van de juiste thermodynamische vergelijking.
Vraag: Wat is ZnF2?
A: ZnF2 is de chemische formule voor zinkdifluoride, een verbinding van zink en fluor.
Vraag: Hoeveel mol ZnF2?
A: Het aantal mol in ZnF2 hangt af van de gegeven massa en de molaire massa van de verbinding.
