Koperbromide (CuBr2) is een verbinding gemaakt van koper en broom. Het vertoont een blauwgroene kleur, vaak gebruikt bij organische synthese en als Lewis-zuurkatalysator.
| IUPAC-naam | Koper(II)bromide |
| Moleculaire formule | CuBr2 |
| CAS-nummer | 7789-45-9 |
| Synoniemen | Koperbromide, koperdibromide |
| InChi | InChI=1S/Br2.Cu |
Eigenschappen van koperbromide
Koperbromide-formule
De formule voor koperbromide is CuBr2. Het vertegenwoordigt een verbinding gevormd uit één koperatoom en twee broomatomen. Deze combinatie resulteert in een blauwgroene kristallijne substantie, die vaak wordt gebruikt in verschillende chemische reacties.
Molaire massa koperbromide
De molaire massa van koperbromide is ongeveer 223,36 gram per mol. Deze waarde wordt verkregen door de atoommassa’s van één koperatoom (Cu) en twee broomatomen (Br) aanwezig in de formule CuBr2 op te tellen.
Kookpunt van koperbromide
Koperbromide heeft een kookpunt van ongeveer 1294 graden Celsius (ongeveer 2361 graden Fahrenheit). Deze temperatuur geeft het punt aan waarop de stof onder standaard atmosferische druk overgaat van vloeistof naar gas.
Smeltpunt van koperbromide
Het smeltpunt van koperbromide is ongeveer 498 graden Celsius (ongeveer 928 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop de vaste stof bij verhitting in een vloeibare toestand verandert.
Dichtheid van koperbromide g/ml
De dichtheid van koperbromide is ongeveer 4,71 gram per milliliter (g/ml) bij standaard kamertemperatuur en atmosferische druk. Deze waarde onthult de hoeveelheid aanwezige massa per volume-eenheid van de stof.
Molecuulgewicht koperbromide
Cupribromide heeft een molecuulgewicht van ongeveer 223,36 gram per mol. Deze waarde is cruciaal voor verschillende chemische berekeningen en dient als referentie voor de hoeveelheid stof die in een bepaald monster aanwezig is.
Structuur van koperbromide
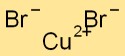
Cupribromide heeft een kristalroosterstructuur waarin koperatomen omgeven zijn door broomatomen en omgekeerd. Deze opstelling vormt een stabiel en geordend patroon, dat bijdraagt aan de fysieke eigenschappen van de verbinding.
Oplosbaarheid van koperbromide
Cupribromide heeft een beperkte oplosbaarheid in water. Het is beter oplosbaar in organische oplosmiddelen. De oplosbaarheid hangt af van factoren zoals de temperatuur en de aard van het gebruikte oplosmiddel. Het begrijpen van de oplosbaarheid ervan is van vitaal belang voor verschillende toepassingen in de chemie en de industrie.
| Verschijning | Blauwgroene kristallen |
| Soortelijk gewicht | Niet beschikbaar |
| Kleur | Blauw groen |
| Geur | Geurloos |
| Molaire massa | 223,36 g/mol |
| Dikte | 4,71 g/ml |
| Fusie punt | 498°C (928°F) |
| Kookpunt | 1294°C (2361°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Beperkte oplosbaarheid |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ethanol, ether en benzeen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van koperbromide
Cupribromide brengt bepaalde veiligheids- en gevaaroverwegingen met zich mee. Het is essentieel om met voorzichtigheid met deze verbinding om te gaan vanwege de potentiële toxiciteit en irriterende eigenschappen ervan. Direct contact met de huid of ogen kan irritatie en ongemak veroorzaken. Inademing van stof of dampen kan de luchtwegen irriteren. Daarom moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen bij het werken met koperbromide. Bovendien moet het uit de buurt van onverenigbare stoffen worden bewaard om mogelijke reacties te voorkomen. In geval van inslikken of accidentele blootstelling, dient u onmiddellijk medische hulp in te roepen. Het naleven van de veiligheidsmaatregelen is van cruciaal belang om een veilige hantering en gebruik van koperbromide te garanderen.
| Gevarensymbolen | Irriterend, bijtend |
| Beveiligingsbeschrijving | Afhandelen met borg. Vermijd direct contact met huid en ogen. Gebruik geschikte beschermende uitrusting. |
| VN-identificatienummers | Niet beschikbaar |
| HS-code | Niet beschikbaar |
| Gevarenklasse | Irriterend |
| Verpakkingsgroep | Niet beschikbaar |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan de luchtwegen irriteren. |
Methoden voor de synthese van koperbromide
Er zijn verschillende methoden voor het synthetiseren van cupribromide (CuBr2). Een gebruikelijke aanpak omvat de directe combinatie van metallisch koper of koperoxide met broomwaterstofzuur . Bij deze methode voegen we koper toe aan het zuur en ondergaat het een chemische reactie, resulterend in de vorming van koperbromide en het vrijkomen van waterstofgas.
Een andere methode is de reactie tussen kopercarbonaat of koperhydroxide met broomwaterstofzuur. Het carbonaat of hydroxide reageert met het zuur en produceert koperbromide, water en kooldioxide.
Om koperbromide te synthetiseren kan bovendien een dubbele verdringingsreactie worden gebruikt. Deze methode omvat de reactie tussen een oplosbaar koperzout, zoals kopersulfaat, en een oplosbaar bromidezout, zoals natriumbromide. De reactie leidt tot de vorming van cupribromide en een oplosbaar zout van het andere metaal of metalloïde dat in de reactie aanwezig is.
Om koperbromide te synthetiseren kunnen we bovendien elektrochemische methoden gebruiken. Deze methoden omvatten het gebruik van een elektrochemische cel met koperen elektroden en een bromide-ionenbron. Wanneer we stroom aanleggen, vormt zich op de ene elektrode koperbromide, terwijl op de andere elektrode broomgas vrijkomt.
De keuze van de synthesemethode hangt af van factoren zoals de beschikbaarheid van reagentia, de gewenste zuiverheid en de mate van reactie. Tijdens alle syntheseprocedures moeten de juiste hantering en veiligheidsmaatregelen in acht worden genomen.
Gebruik van koperbromide
Koperbromide (CuBr2) vindt vanwege zijn unieke eigenschappen veelzijdige toepassingen in verschillende industrieën. Hier zijn enkele van de opmerkelijke toepassingen:
- Organische synthese : Koperbromide dient als katalysator bij veel organische reacties, zoals de Ullmann-koppeling en de Wurtz-Fittig-reactie, waardoor de vorming van koolstof-koolstof- en koolstof-heteroatoombindingen mogelijk is.
- Fotografie : Het wordt gebruikt in fotografische processen om emulsies gevoelig te maken en de gevoeligheid van films en platen te verbeteren, waardoor het vastleggen van beelden van hoge kwaliteit wordt vergemakkelijkt.
- Galvaniseren : Koperbromide wordt gebruikt bij galvaniseerprocessen om lagen koper op oppervlakken af te zetten, wat corrosiebestendigheid en decoratieve afwerkingen oplevert.
- Halfgeleiderindustrie : In de elektronicasector wordt het gebruikt bij de synthese van nanokristallen op basis van koperbromide, die toepassingen hebben in de opto-elektronica en fotonica.
- Vlamkleurstof : Koperbromide wordt gebruikt in pyrotechniek en vuurwerk om een groene vlamkleur te produceren, waardoor displays visueel aantrekkelijker worden.
- Geneeskunde : Hoewel beperkt, is het onderzocht op mogelijke therapeutische toepassingen vanwege de antibacteriële eigenschappen.
- Lasertechnologie : Koperbromidelasers worden gebruikt in wetenschappelijk onderzoek, lasergeïnduceerde fluorescentiestudies en om laserpulsen met hoge energie te genereren.
- Chemische analyse : Het wordt gebruikt in de analytische chemie voor kwalitatieve en kwantitatieve analyses.
- Bromeringsreacties : Koperbromide werkt als bromeringsmiddel en vergemakkelijkt de toevoeging van broom aan organische verbindingen.
- Lithografie : Bij lithografische processen zijn koperbromideverbindingen onderzocht voor gebruik in micro- en nanofabricagetechnieken.
De verschillende toepassingen van koperbromide tonen het belang ervan op verschillende gebieden aan, waardoor het een waardevolle verbinding is in industriële en wetenschappelijke inspanningen.
Vragen:
Vraag: Wat is de molaire massa van koper(II)bromide?
A: De molaire massa van cupri(II)bromide is ongeveer 223,36 g/mol.
Vraag: Wat is de formule voor koper(II)bromide?
A: De formule voor koper(II)bromide is CuBr2.
Vraag: Is koper(II)bromide oplosbaar in water?
A: Cupri(II)bromide heeft een beperkte oplosbaarheid in water.
Vraag: Waar wordt koper(II)bromide voor gebruikt?
A: Koper(II)bromide wordt gebruikt als katalysator in de organische synthese, fotografie, galvanisatie en de halfgeleiderindustrie.
Vraag: Zijn zink- en koperbromide een eenmalige vervanging?
A: Ja, zink en koper(II)bromide ondergaan een enkele vervangingsreactie, waarbij zinkbromide en metallisch Cu worden geproduceerd.
Vraag: Vindt er een reactie plaats wanneer waterige oplossingen van bariumacetaat en koper (II) bromide worden gecombineerd?
A: Ja, er vindt een reactie plaats die resulteert in de vorming van bariumbromide en koper(II)acetaat.
Vraag: Welke ionen worden eventueel gevormd als koper(II)bromide aan water wordt toegevoegd?
A: Wanneer cupri(II)bromide aan water wordt toegevoegd, dissocieert het in Cu^2+-ionen en bromide-ionen (Br^-).
Vraag: Vormt CuBr2 een ionbinding?
A: Ja, CuBr2 vormt een ionische binding tussen koper- en broomionen.
Vraag: Vormt CuBr2 een covalente binding?
A: Nee, CuBr2 vormt geen covalente binding.
Vraag: Is CuBr2 oplosbaar in water?
A: CuBr2 heeft een beperkte oplosbaarheid in water.
Vraag: Wat is CuBr2?
A: CuBr2 is de chemische formule voor koper(II)bromide, een blauwgroene kristallijne verbinding.
Vraag: Is CuBr2 oplosbaar of onoplosbaar?
A: CuBr2 is slecht oplosbaar in water.
Vraag: Wat is het massapercentage koper in CuBr2?
A: Het massapercentage koper in CuBr2 bedraagt ongeveer 47,5%.
