Zinkchloride (ZnCl2) is een witte kristallijne verbinding. Het wordt gebruikt in diverse industriële toepassingen, zoals soldeervloeimiddelen, chemische synthese en galvaniseren. Het is zeer oplosbaar in water.
| IUPAC-naam | Zinkchloride |
| Moleculaire formule | ZnCl2 |
| CAS-nummer | 7646-85-7 |
| Synoniemen | Zinkboter; Zinkdichloride; Zink(II)chloride; Zinkboter; CI77043 |
| InChi | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschappen van zinkchloride
Zinkchloride-formule
De chemische formule voor zinkdichloride is ZnCl2. Het bestaat uit één zinkatoom (Zn) en twee chlooratomen (Cl). Deze ionische verbinding vormt een witte kristallijne vaste stof met een duidelijke structuur.
Zinkchloride molaire massa
De molaire massa van zinkdichloride is ongeveer 136,29 gram per mol (g/mol). Het is afgeleid van de som van de atoommassa’s van één zinkatoom en twee chlooratomen.
Kookpunt van zinkchloride
Zinkdichloride heeft een relatief hoog kookpunt van ongeveer 732 graden Celsius (C) of 1.350 graden Fahrenheit (F). Bij deze temperatuur verandert het van vloeibare naar gasvormige toestand.
Smeltpunt van zinkchloride
Het smeltpunt van zinkdichloride is ongeveer 290 graden Celsius (C) of 554 graden Fahrenheit (F). Bij deze temperatuur verandert het vaste zinkdichloride in de vloeibare toestand.
Dichtheid van zinkchloride g/ml
De dichtheid van zinkdichloride is ongeveer 2,91 gram per milliliter (g/ml) bij kamertemperatuur. Deze eigenschap beschrijft de massa per volume-eenheid.
Zinkchloride Molecuulgewicht
Het molecuulgewicht van zinkdichloride, berekend op basis van de chemische formule, is ongeveer 136,29 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van de samenstellende atomen.
Structuur van zinkchloride
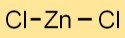
Zinkdichloride heeft een kristalroosterstructuur met Zn2+-kationen en clanionen die bij elkaar worden gehouden door ionische bindingen. De opstelling vormt een stabiel en geordend driedimensionaal netwerk.
Oplosbaarheid van zinkchloride
Zinkdichloride is zeer oplosbaar in water, wat betekent dat het gemakkelijk oplost in de aanwezigheid van watermoleculen. Deze eigenschap draagt bij aan het wijdverbreide gebruik ervan in verschillende industriële toepassingen en chemische processen.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2,91 g/ml |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 136,29 g/mol |
| Dikte | 2,91 g/cm³ |
| Fusie punt | 290°C (554°F) |
| Kookpunt | 732°C (1350°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals alcohol en aceton |
| Dampdruk | 1 mmHg bij 359°C |
| Dampdichtheid | 5,4 (lucht = 1) |
| pKa | -1,9 |
| pH | ~5 (0,1 M oplossing in water) |
Veiligheid en gevaren van zinkchloride
Zinkdichloride brengt bepaalde veiligheidsrisico’s met zich mee die een zorgvuldige omgang vereisen. Direct contact met de huid of ogen kan irritatie en brandwonden veroorzaken. Inademing van de dampen kan de luchtwegen irriteren. Het is essentieel om beschermende uitrusting zoals handschoenen en een veiligheidsbril te dragen bij het hanteren van de verbinding. Bovendien moet het worden opgeslagen in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. In geval van inslikken of accidentele blootstelling, dient u onmiddellijk medische hulp in te roepen. Voorkom dat het in het milieu terechtkomt, omdat het schadelijk kan zijn voor het waterleven. Door de juiste veiligheidsmaatregelen en richtlijnen te volgen, kunnen de risico’s die verband houden met zinkdichloride effectief worden geminimaliseerd.
| Gevarensymbolen | Bijtend (C); Schadelijk (Xn) |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Gebruik in een goed geventileerde ruimte. Draag handschoenen en een veiligheidsbril. In geval van contact of inslikken, een arts raadplegen. Niet in het milieu laten terechtkomen. Verwijderd houden van onverenigbare stoffen. |
| VN-identificatienummers | UN-nummer 2331 (watervrij zinkdichloride); UN-nr. 2332 (Zinkdichloride, oplossing) |
| HS-code | 28273990 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Schadelijk bij inslikken of inademen. |
Methoden voor de synthese van zinkchloride
Verschillende methoden maken de synthese van zinkdichloride mogelijk.
Een gebruikelijke aanpak omvat de reactie van zinkoxide (ZnO) met zoutzuur (HCl) . Bij deze methode voegt een chemicus langzaam ZnO toe aan een HCl-oplossing, terwijl hij continu roert. Bij de reactie ontstaan zinkdichloride en water als bijproducten. Een andere methode is om zinkmetaal rechtstreeks te combineren met chloorgas (Cl2). Deze reactie vereist een zorgvuldige controle van temperatuur en druk om een succesvol resultaat te garanderen.
Een alternatief proces omvat het oplossen van het zinkmetaal in een oplossing van HCl, resulterend in de vorming van zinkdichloride en waterstofgas (H2). Door HCl te behandelen met zinkcarbonaat (ZnCO3) of zinkhydroxide (Zn(OH)2) ontstaan zinkdichloride, water en kooldioxide (CO2) als bijproducten.
Zinksulfaat (ZnSO4) en bariumchloride (BaCl2) ondergaan een dubbele ontledingsreactie, waarbij zinkdichloride ontstaat, evenals de vorming van bariumsulfaat (BaSO4). Door deze twee verbindingen te mengen slaat het zinkdichloride neer, terwijl het bariumsulfaat (BaSO4) in de oplossing blijft.
Elk van deze methoden biedt een route voor de synthese van zinkdichloride en de keuze van de methode hangt af van factoren zoals de beschikbaarheid van reagentia, reactieomstandigheden en de gewenste zuiverheid van het eindproduct.
Gebruik van zinkchloride
Zinkdichloride vindt vanwege zijn veelzijdige eigenschappen een breed scala aan toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen van zinkdichloride:
- Verzinken: Zinkdichloride speelt een essentiële rol in het verzinkproces om corrosie van metalen zoals staal en ijzer te voorkomen. Het vormt een beschermende zinklaag, waardoor de levensduur en duurzaamheid worden verbeterd.
- Soldeervloeimiddel: Bij hardsoldeerwerkzaamheden werkt zinkdichloride als een vloeimiddel om metaaloxiden van het oppervlak van metalen te verwijderen, waardoor een betere hechting en een sterke binding tussen het soldeer en het metaal ontstaat.
- Chemische synthese: Het dient als katalysator of reagens bij veel chemische reacties, zoals acylering en Friedel-Crafts-uitdroging.
- Houtbehoud: Toepassingen van houtverduurzaming gebruiken zinkdichloride om hout te beschermen tegen schimmelrot en insecten, waardoor de levensduur ervan wordt verlengd.
- Textielverwerking: In de textielindustrie vergemakkelijkt het de productie van gemerceriseerde katoenen stoffen, waardoor wenselijke eigenschappen worden verkregen, zoals verhoogde glans en verbeterde sterkte.
- Batterij-elektrolyt: Zinkdichloride fungeert als elektrolyt in sommige batterijen, zoals de zink-koolstofbatterij, en helpt de ionenstroom tussen de elektroden te vergemakkelijken.
- Deodorant en anti-transpirant: Het is een veelgebruikt ingrediënt in anti-transpiranten vanwege de adstringerende eigenschappen die de zweetproductie helpen verminderen en de lichaamsgeur onder controle houden.
- Farmaceutische producten: Zinkdichloride vindt toepassing in verschillende farmaceutische formuleringen, vooral in mondspoelingen, keelpastilles en plaatselijke antiseptische oplossingen.
- Verfindustrie: De verfindustrie gebruikt zinkdichloride als bijtmiddel in het verfproces om de kleurechtheid van stoffen met kleurstoffen te verbeteren.
- Kleefmiddelformuleringen: Fabrikanten nemen zinkdichloride op in kleefmiddelformuleringen om de hechtingseigenschappen van lijmen en cementen te verbeteren.
De veelzijdigheid van zinkdichloride maakt het tot een essentiële verbinding in veel industriële processen en alledaagse producten, en draagt bij aan de vooruitgang van verschillende belangrijke industrieën.
Vragen:
Vraag: Is ZnCl2 oplosbaar in water?
A: Ja, ZnCl2 is zeer oplosbaar in water.
Vraag: Wat is de netto ionische vergelijking voor de reactie van ZnCl2 met NaOH?
A: De netto ionische vergelijking is Zn²⁺(aq) + 2OH⁻(aq) → Zn(OH)₂(s).
Vraag: Is ZnCl2 oplosbaar?
A: Ja, ZnCl2 is oplosbaar in water.
Vraag: Is ZnCl2 ionisch of moleculair?
A: ZnCl2 is een ionische verbinding.
Vraag: Welk type binding komt voor in zink(II)chloride, ZnCl2?
A: Ionische binding vindt plaats in ZnCl2.
Vraag: Welke verandering zou de snelheid van de ZnCl2-productie kunnen verlagen?
A: Het verlagen van de reactietemperatuur zou de ZnCl2-productiesnelheid kunnen verlagen.
Vraag: Is ZnCl2 vast?
A: Ja, ZnCl2 is een vaste stof bij kamertemperatuur.
Vraag: Is ZnCl2 een zout?
A: Ja, ZnCl2 wordt als een zout beschouwd.
Vraag: Hoe krijg je zinkchloride uit zink?
A: Bij de reactie van zink met zoutzuur ontstaat zinkchloride.
Vraag: Wat is de formule voor zinkchloride?
A: De formule voor zinkchloride is ZnCl2.
Vraag: Zijn zinkchloridebatterijen schadelijk voor de aarde?
A: Ja, zinkchloridebatterijen kunnen schadelijk zijn voor het milieu als ze niet op de juiste manier worden weggegooid.
Vraag: Wat is de molaire massa van zinkchloride?
A: De molmassa van zinkchloride is ongeveer 136,29 g/mol.
