2 Butanon, ook bekend als methylethylketon of MEK, is een kleurloze, brandbare vloeistof met een zoete, fruitige geur. Het wordt vaak gebruikt als oplosmiddel in verschillende industriële en huishoudelijke toepassingen.
| IUPAC-naam | 2-Butanon |
| Moleculaire formule | C4H8O |
| CAS-nummer | 78-93-3 |
| Synoniemen | Methylethylketon (MEK), butaan-2-on, 2-butanon, 3-oxobutan-2-on |
| InChi | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
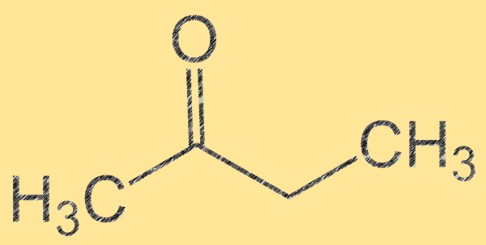
Structuur van butanon
Butanon heeft de molecuulformule C4H8O en de moleculaire structuur ervan kan worden weergegeven als CH3C(O)CH2CH3. Het is een kleurloze, brandbare vloeistof met een zoete, fruitige geur. Butanon is een keton, wat betekent dat het een carbonylgroep (C=O) bevat die aan een koolstofatoom is bevestigd. Deze carbonylgroep maakt butanon tot een belangrijk tussenproduct bij de synthese van verschillende organische verbindingen.
2-Butanon molaire massa
Butanon, ook bekend als methylethylketon (MEK), heeft een molaire massa van 72,11 g/mol. Dit is de hoeveelheid stof in een bepaald monster butanon, uitgedrukt in gram per mol. Molaire massa is een belangrijke eigenschap van butanon die wordt gebruikt in verschillende berekeningen en experimenten in de scheikunde, bijvoorbeeld om de massa te bepalen van een stof die nodig is om te reageren met een andere stof in een specifieke molaire verhouding. De molaire massa van butanon kan ook worden gebruikt om de massa om te zetten in mol, wat nuttig is in veel toepassingen, waaronder chemische reacties, chemische synthese en analytische chemie.
Kookpunt van MEK
Het kookpunt van MEK is 80,6°C (176,5°F). Dit is de temperatuur waarbij MEK overgaat van vloeistof naar gas. Het kookpunt is een belangrijke eigenschap van MEK omdat het het vermogen om te verdampen en een damp te vormen beïnvloedt. In sommige toepassingen wordt MEK bijvoorbeeld als oplosmiddel gebruikt en is het wenselijk dat het snel verdampt, zodat de opgeloste stof kan worden verwijderd. Bij andere toepassingen is het wenselijk dat MEK in vloeibare vorm blijft, zodat het gebruikt kan worden als oplosmiddel voor reacties die bij of onder het kookpunt worden uitgevoerd.
MEK Smeltpunt
Het smeltpunt van MEK is -93,9°C (-136,0°F). Dit is de temperatuur waarbij MEK verandert van vaste naar vloeibare toestand. Het smeltpunt is een belangrijke eigenschap van MEK omdat het van invloed is op het vermogen ervan om als oplosmiddel voor vaste stoffen te worden gebruikt. MEK kan bijvoorbeeld worden gebruikt als oplosmiddel voor bepaalde vaste stoffen waarvan het smeltpunt lager is dan het eigen smeltpunt, zoals vetten, was en harsen.
MEK-dichtheid g/ml
De dichtheid van MEK is 0,80 g/ml. Dit is de massa per volume-eenheid van MEK en is een belangrijke eigenschap die in veel toepassingen wordt gebruikt, waaronder het berekenen van de hoeveelheid MEK die nodig is voor een specifiek volume. De dichtheid van MEK wordt ook gebruikt om het molaire volume ervan te berekenen, het volume dat wordt ingenomen door één mol MEK. Deze informatie is nuttig bij verschillende experimenten, waaronder het bepalen van de molaire massa van een stof.
MEK-molecuulgewicht
Het molecuulgewicht van MEK is 72,11 g/mol. Het is de som van de atoomgewichten van de atomen in een MEK-molecuul en is een belangrijke eigenschap die in veel toepassingen wordt gebruikt, waaronder het berekenen van de molaire massa van een stof. Het molecuulgewicht van MEK kan worden gebruikt om de massa om te zetten in mol, wat nuttig is in veel toepassingen, waaronder chemische reacties, chemische synthese en analytische chemie.
MEK-formule
De chemische formule voor MEK is C4H8O. Deze formule vertegenwoordigt relatieve verhoudingen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,79 – 0,80 |
| Kleur | Kleurloos |
| Geur | Zoet, fruitig |
| Molaire massa | 72,11 g/mol |
| Dikte | 0,79 – 0,80 g/ml |
| Fusie punt | -93,9°C (-136,0°F) |
| Kookpunt | 80,6°C (176,5°F) |
| Flitspunt | 12°C (53,6°F) |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in de meeste organische oplosmiddelen |
| Dampdruk | 38 mmHg (20°C) |
| Dampdichtheid | 2,3 (lucht = 1) |
| pKa | 20.2 |
| pH | 7 (neutraal) |
Opmerking: De waarden in deze tabel zijn bij benadering en kunnen enigszins variëren, afhankelijk van de bron en de meetomstandigheden.
Veiligheid en gevaren van butanon
Butanon, ook bekend als methylethylketon, is een ontvlambare en vluchtige vloeistof die irritatie aan de huid, ogen en luchtwegen kan veroorzaken als er niet met de juiste veiligheidsmaatregelen mee wordt omgegaan. Inademing van hoge concentraties butanon kan hoofdpijn, duizeligheid, misselijkheid en bewustzijnsverlies veroorzaken. Langdurige blootstelling aan lage concentraties butanon kan nier- en leverschade veroorzaken. Het is ook licht ontvlambaar en kan gemakkelijk ontbranden, wat brandgevaar met zich meebrengt. Bij het gebruik van butanon is het belangrijk om in een goed geventileerde ruimte te werken, beschermende kleding en een bril te dragen en contact met de huid te vermijden. Bij contact met de huid of ogen onmiddellijk met water afspoelen en indien nodig een arts raadplegen. Bij inslikken geen braken opwekken en onmiddellijk medische hulp inroepen. Butanon moet worden bewaard op een koele, droge, goed geventileerde plaats, uit de buurt van warmtebronnen en vlammen.
| Gevarensymbolen | Ontvlambare vloeistof, irriterend |
| Beveiligingsbeschrijving | S2 – Buiten bereik van kinderen bewaren<br>S16 – Verwijderd houden van ontstekingsbronnen<br>S24/25 – Contact met huid en ogen vermijden<br>S26 – Bij contact met de ogen onmiddellijk met veel water afspoelen en medisch advies inwinnen |
| AN-identificaties | UN1090 |
| HS-code | 29141100 |
| Gevarenklasse | 3 (ontvlambare vloeistof) |
| Verpakkingsgroep | II |
| Toxiciteit | LD50 (oraal, rat) – 4.220 mg/kg |
Butanonsynthesemethoden
Butanon kan op verschillende manieren worden gesynthetiseerd, waaronder de directe oxidatie van 2-butanol en de aldolcondensatie van aceton en 2-propanol.
De directe oxidatiemethode omvat de reactie van 2-butanol met een oxidatiemiddel zoals chroomzuur, waterstofperoxide of een mengsel van salpeterzuur en zwavelzuur. De reactie vindt plaats in een zuur milieu en het resulterende methylethylketon wordt door destillatie van het reactiemengsel gescheiden.
De aldolcondensatiemethode omvat de reactie van aceton met 2-propanol in aanwezigheid van een sterke base zoals natriumhydroxide of kaliumhydroxide. De reactie produceert een mengsel van methylethylketon en andere bijproducten, die door destillatie worden gescheiden.
Een andere synthesemethode omvat de reactie van aceton met formaldehyde in aanwezigheid van een katalysator zoals zwavelzuur of p-tolueensulfonzuur. Deze reactie produceert een mengsel van methylethylketon, formaldehyde en andere bijproducten, die door destillatie worden gescheiden.
Over het geheel genomen vereist de synthese van methylethylketon een zorgvuldige controle van de reactieomstandigheden om de productie van een product van hoge kwaliteit met minimale bijproducten te garanderen. Het is belangrijk om de juiste veiligheidsmaatregelen te volgen bij het werken met de chemicaliën en reacties die betrokken zijn bij de synthese van methylethylketon.
Gebruik van butanon
Butanon, ook bekend als methylethylketon, heeft een breed scala aan industriële toepassingen vanwege zijn solvabiliteit, vluchtigheid en lage kookpunt. Enkele van de meest voorkomende toepassingen van butanon zijn:
- Oplosmiddel: Methylethylketon wordt gebruikt als oplosmiddel voor verschillende stoffen zoals harsen, lijmen, inkten, verfafbijtmiddelen, drukinkten, nitrocelluloselakken en synthetische rubbers.
- Reinigingsmiddel: De elektronica-industrie gebruikt het als reinigingsmiddel om metalen onderdelen en oppervlakken te reinigen van vet, olie en andere verontreinigingen.
- Farmaceutische producten: In de farmaceutische industrie wordt methylethylketon gebruikt als oplosmiddel bij de productie van vaccins, antibiotica en andere medicijnen.
- Coatings: Coatings voor hout, papier en andere materialen gebruiken ook methylethylketon als oplosmiddel bij de productie ervan, evenals bij de vervaardiging van vernissen, lakken en andere beschermende coatings.
- Parfums: De cosmetische en voedingsindustrie gebruikt methylethylketon als oplosmiddel voor parfums en smaakstoffen.
- Lijmen: Bij de productie van lijmen en kitten wordt ook methylethylketon als oplosmiddel gebruikt.
Naast zijn industriële toepassingen is methylethylketon ook onderzocht op zijn potentieel als brandstof. De hoge energie-inhoud en de lage toxiciteit in vergelijking met andere brandstoffen maken het tot een veelbelovende alternatieve energiebron.
Vragen:
Wat levert de volgende reactie op? 2-butanon + h2/ni-katalysator
De reactie van 2-butanon met waterstofgas over een nikkelkatalysator staat bekend als een hydrogeneringsreactie. Deze reactie levert het volgende product op:
2-butanon + H2 -> 2-butanol
Reductie van de dubbele binding tussen koolstof- en zuurstofatomen in de ketongroep van 2-butanon resulteert in de vorming van 2-butanol door activering van waterstofgas door een nikkelkatalysator. De chemische industrie gebruikt deze reactie vaak om 2-butanol te produceren, een waardevol oplosmiddel en grondstof voor andere chemische productie. Zorgvuldige controle van temperatuur, druk en katalysatortype is noodzakelijk voor efficiënte en selectieve hydrogenering van 2-butanon tot 2-butanol.
Is 2-butanon een keton?
De organische chemie karakteriseert 2-butanon, ook bekend als methylethylketon, als een type keton met een carbonylgroep (C=O) gekoppeld aan een koolstofatoom binnen een koolwaterstofketen. De carbonylgroep van 2-butanon bevindt zich tussen twee koolstofatomen, vandaar het label “methylethylketon”.
Wat is het infraroodspectrum van 2-butanon?
Het IR (infrarood) spectrum van 2-butanon (ook bekend als methylethylketon) kan belangrijke informatie verschaffen over de moleculaire structuur en functionele groepen ervan. Het IR-spectrum van 2-butanon vertoont over het algemeen de volgende hoofdabsorptiebanden:
- Carbonyl-strekking: deze band verschijnt als een scherpe piek tussen 1700 en 1700 cm^-1 en is kenmerkend voor de C=O-functionele groep van het keton.
- Alkyl-strekking: De pieken tussen 2900 en 3000 cm^-1 komen overeen met de rekvibraties van de CH2- en CH3-groepen in 2-butanon.
- CH-buiging: De pieken tussen 1400 en 1500 cm^-1 komen overeen met de buigtrillingen van CH-bindingen in 2-butanon.
- COC-buiging: De piek tussen 1300 en 1400 cm^-1 komt overeen met de buigtrillingen van de COC-groep in 2-butanon.
Het is belangrijk op te merken dat het IR-spectrum van 2-butanon wordt beïnvloed door de monstervoorbereiding en de gebruikte instrumenten, evenals door de aanwezigheid van onzuiverheden of verontreinigingen.
