2-Butanol is een kleurloze, brandbare vloeistof met een zoete geur. Het wordt vaak gebruikt als oplosmiddel en bij de productie van chemicaliën zoals methylethylketon en butylacetaat.
| IUPAC-naam | 2-Butanol |
| Moleculaire formule | C4H10O |
| CAS-nummer | 78-92-2 |
| Synoniemen | Droge butylalcohol, 2-butylalcohol, butaan-2-ol, ethylmethylcarbinol |
| InChi | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Eigenschappen van 2-butanol
2-butanolformule
De chemische formule voor 2-Butanol is C4H10O, wat aangeeft dat het vier koolstofatomen, tien waterstofatomen en één zuurstofatoom bevat. Het is een isomeer van butanol en heeft de structuurformule CH3CH(OH)CH2CH3. De “2” in de naam van de verbinding geeft de positie van de hydroxylgroep op de koolstofketen aan.
Molaire massa 2-butanol
De molaire massa van C4H10O is 74,12 g/mol. Deze waarde kan worden verkregen door de atoommassa’s van alle atomen in de verbinding op te tellen, namelijk 12,01 g/mol voor koolstof, 1,01 g/mol voor waterstof en 16,00 g/mol voor zuurstof. Molaire massa is een belangrijke eigenschap van C4H10O omdat deze wordt gebruikt om de hoeveelheid verbinding te berekenen die nodig is bij chemische reacties.
Kookpunt van 2-butanol
Het kookpunt van C4H10O is 99,5 °C (211,1 °F) bij standaarddruk (1 atm). Dit is de temperatuur waarbij de vloeibare toestand van de verbinding verandert in de gasvormige toestand. Het kookpunt van C4H10O is hoger dan dat van butaan (−0,5 °C) en buteen (−6,3 °C) vanwege de waterstofbinding en het molecuulgewicht.
Smeltpunt van 2-butanol
Het smeltpunt van C4H10O is −114,7 °C (−174,5 °F). Dit is de temperatuur waarbij de vaste toestand van de verbinding verandert in de vloeibare toestand. Het smeltpunt van C4H10O is lager dan dat van butaan (−138,4 °C) en buteen (−185,3 °C) vanwege de vertakte structuur en waterstofbruggen.
2-Butanoldichtheid g/ml
De dichtheid van C4H10O is 0,809 g/ml bij 25°C (77°F). Deze waarde geeft de massa van de verbinding per volume-eenheid van de stof aan. De dichtheid van C4H10O is hoger dan die van butaan (0,588 g/ml) en buteen (0,587 g/ml) vanwege het molecuulgewicht en de intermoleculaire krachten.
Molecuulgewicht 2-butanol
Het molecuulgewicht van C4H10O is 74,12 g/mol. Het is de som van de atoomgewichten van alle atomen in een molecuul van de verbinding. Het molecuulgewicht wordt gebruikt om andere eigenschappen van de verbinding te berekenen, zoals de molaire massa, het kookpunt en de dichtheid.
Structuur van 2-butanol
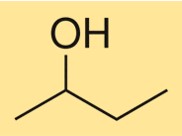
De structuur van C4H10O wordt gekenmerkt door een vertakte koolstofketen met een hydroxylgroep aan het tweede koolstofatoom. Het is een primaire alcohol met een chiraal centrum, wat betekent dat het bestaat als twee stereo-isomeren, (R)-C4H10O en (S)-C4H10O. De verbinding heeft een driedimensionale structuur vanwege de tetraëdrische opstelling van koolstof- en zuurstofatomen rond de hydroxylgroep.
Oplosbaarheid van 2-butanol
C4H10O is een polaire verbinding en is gedeeltelijk oplosbaar in water. De oplosbaarheid van C4H10O in water is 80 g/l bij 25°C (77°F). De verbinding is beter oplosbaar in organische oplosmiddelen zoals ethanol, ether en aceton. De oplosbaarheid van C4H10O wordt beïnvloed door factoren zoals temperatuur, druk en de aard van het oplosmiddel.
| Verschijning | Heldere vloeistof |
| Soortelijk gewicht | 0,810 g/ml bij 25°C (77°F) |
| Kleur | Kleurloos |
| Geur | Kenmerkend |
| Molaire massa | 74,12 g/mol |
| Dikte | 0,809 g/ml bij 25°C (77°F) |
| Fusie punt | −114,7°C (−174,5°F) |
| Kookpunt | 99,5°C (211,1°F) bij een druk van 1 atm |
| Flitspunt | 39°C (102°F) gesloten cup |
| oplosbaarheid in water | 80 g/l bij 25°C (77°F) |
| Oplosbaarheid | Oplosbaar in ethanol, ether en aceton |
| Dampdruk | 8,7 mmHg bij 25°C (77°F) |
| Dampdichtheid | 2,6 (lucht = 1) |
| pKa | 16 |
| pH | 7,0-8,5 |
Veiligheid en gevaren van 2-butanol
C4H10O wordt als een relatief veilige chemische stof beschouwd als het op de juiste manier wordt behandeld. Blootstelling aan hoge concentraties kan echter irritatie aan de ogen, huid en luchtwegen veroorzaken. Het kan ook hoofdpijn, duizeligheid en misselijkheid veroorzaken. Inslikken van C4H10O kan gastro-intestinale irritatie en mogelijke depressie van het centrale zenuwstelsel veroorzaken. Bovendien is C4H10O brandbaar en kan brandgevaar opleveren. Het moet worden bewaard op een koele, droge, goed geventileerde plaats, uit de buurt van ontstekingsbronnen. Bij het hanteren van deze chemische stof moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen. Gemorste vloeistoffen moeten onmiddellijk worden opgeruimd met behulp van de juiste procedures.
| Gevarensymbolen | F, Xi |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. BIJ CONTACT MET DE HUID (of het haar): Verwijder onmiddellijk alle verontreinigde kleding. Huid afspoelen met water/douchen. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. NA INSLIKKEN: Mond spoelen. GEEN braken opwekken. Als u zich onwel voelt, bel dan een ANTIGIFCENTRUM of een arts. |
| VN-identificatienummers | UN1120 |
| HS-code | 2905.13.00 |
| Gevarenklasse | 3 – Ontvlambare vloeistoffen |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (oraal, rat): 4,6 g/kg; LC50 (inhalatie, rat): 2.100 ppm/4 uur |
Methoden voor de synthese van 2-butanol
Er kunnen verschillende methoden worden gebruikt om C4H10O te synthetiseren.
Eén methode omvat de reductie van aceton met behulp van natriumboorhydride in aanwezigheid van een nikkel- of palladiumkatalysator. De reactie produceert een mengsel van C4H10O en zijn isomeer, isobutanol, dat kan worden gescheiden door gefractioneerde destillatie.
Een andere methode omvat de hydratatie van 1-buteen met behulp van zwavelzuur als katalysator. De reactie vormt een mengsel van C4H10O en zijn isomeren, maar het gewenste C4H10O kan worden gescheiden door gefractioneerde destillatie.
Bij het Reppe-chemieproces wordt een palladium- of nikkelkatalysator gebruikt om acetyleen te laten reageren met formaldehyde en water, wat resulteert in de vorming van vinylalcohol. Deze reactie leidt verder tot de synthese van C4H10O. De vinylalcohol ondergaat vervolgens hydrogenering om C4H10O te vormen.
Een andere methode voor het synthetiseren van C4H10O omvat de hydrogenering van crotonaldehyde in aanwezigheid van een nikkelkatalysator. De reactie produceert een mengsel van C4H10O en zijn isomeer, maar het gewenste C4H10O kan worden geïsoleerd door gefractioneerde destillatie.
Gebruik van 2-butanol
C4H10O heeft een verscheidenheid aan toepassingen in verschillende industrieën. Enkele van de toepassingen zijn:
- Oplosmiddel: Gebruikt als oplosmiddel bij de vervaardiging van harsen, vernissen en coatings. Wordt ook gebruikt als oplosmiddel voor cellulose-ethers en -esters.
- Brandstof: Gebruikt als additief voor biobrandstoffen vanwege de lage toxiciteit en hoge energie-inhoud. Er is aangetoond dat het een hogere verbrandingsefficiëntie heeft dan ethanol en wordt onderzocht als een mogelijk alternatief voor benzine.
- Chemisch tussenproduct: gebruikt als grondstof voor de productie van andere chemicaliën zoals methylethylketon, methylisobutylketon en diisobutyleen.
- Parfum en geur: gebruikt als geur- en smaakstof bij de productie van parfums, zepen en andere producten voor persoonlijke verzorging.
- Laboratoriumreagens: Gebruikt als oplosmiddel en reagens bij experimenten in de organische chemie.
- Reinigingsmiddel: Gebruikt als reinigingsmiddel in industriële en huishoudelijke schoonmaakproducten.
- Drukinkt: Wordt ook gebruikt als oplosmiddel bij de productie van drukinkten.
Vragen:
Vraag: Welke carbonylverbinding en Grignard-reagens kunnen worden gebruikt om 2-butanol te bereiden?
A: De carbonylverbinding die kan worden gebruikt om C4H10O te bereiden is butanal (ook bekend als n-butyraldehyde) en het Grignard-reagens dat kan worden gebruikt is ethylmagnesiumbromide. De reactie tussen butanal en ethylmagnesiumbromide levert C4H10O als eindproduct op.
Vraag: Is 2-butanol polair?
A: Ja, C4H10O is polair. Het bevat een hydroxylgroep (-OH), een polaire functionele groep die het molecuul polair maakt.
Vraag: Is 2-butanol oplosbaar in water?
A: Ja, C4H10O is gedeeltelijk oplosbaar in water. De polaire hydroxylgroep van C4H10O zorgt ervoor dat het waterstofbruggen kan vormen met watermoleculen, waardoor het enigszins oplosbaar wordt in water.
Vraag: Heeft 2-butanol een waterstofbrug?
A: Ja, C4H10O kan waterstofbruggen vormen. De hydroxylgroep (-OH) in C4H10O kan waterstofbruggen vormen met andere polaire moleculen die waterstofbindingsplaatsen bevatten, zoals water.
